
1.化学与生活密切相关,下列说法正确的是
A.食品包装袋、食物保鲜膜等材料的主要成份是聚氯乙烯
B.维生素C具有还原性,在人体内起抗氧化作用
C.蛋白质只含C、H、O、N四种元素
D.煤经过气化和液化两个物理变化,可变为清洁能源
21.(8分)6.4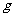 铜与一定浓度的硝酸反应,铜完全溶解,生成
铜与一定浓度的硝酸反应,铜完全溶解,生成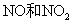 (设不考虑生成
(设不考虑生成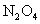 )混合气体3.36L(所有气体体积已换算为标准状况下气体体积)。
)混合气体3.36L(所有气体体积已换算为标准状况下气体体积)。
(1)参加反应消耗的 =
=
(2)若使生成的气体完全被水吸收,求需要消耗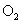 的体积(标准状况下)是多少?
的体积(标准状况下)是多少?
(第(2)问必须写出解题过程)
20.(10分)A、B、C、D为含有相同电子数的分子或离子。通常状况下,D为无色液体。
已知① 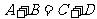
②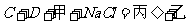
③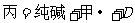
试回答:
(1)甲的结构式为:
(2)C溶于水的过程中发生的反应用化学用语表示为:
(3)工业上可用反应②③制取纯碱,为了检验某含有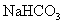 杂质的纯碱样品的纯度,现将
杂质的纯碱样品的纯度,现将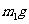 样品加热,其质量变为
样品加热,其质量变为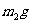 ,则该样品的纯度(质量分数)是:
,则该样品的纯度(质量分数)是:
19.(10分)A是一种盐,它能发生下列转化(某些次要的生成物已略去)。其中B是红棕色固体,I是不溶于稀盐酸的白色沉淀,J是不溶于稀硝酸的浅黄色沉淀。工业上用水、氧气和黄铁矿作用可制取A,同时得到E。
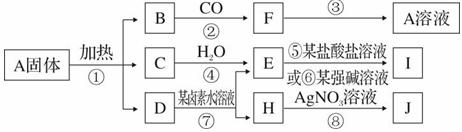
请回答:
(1)写出J、I的化学式:J ,I
(2)写出工业上D转化为C的化学方程式:
(3)写出本题中某盐酸盐的名称为
(4)写出反应⑦的离子方程式:
18.(12分)X、Y、Q、R、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中Y与Q、R与F为同一周期,X与R、Q与F分别为同一主族,Q元素的原子最外层电子数是次外层电子数的三倍,R是所在同周期原子半径最大的元素(0族除外)。又知六种元素所形成的常见单质在常温常压下有三种是气体、三种是固体。请回答些列问题:
(1)在前人探索的基础上,1869年, (填国家)化学家 (填名字)发现了元素周期律,并编制了第一个元素周期表。
(2)X、Q两元素可以组成A、B两种化合物,A在一定条件下可以分解为B。
①用电子式表示B的形成过程
②B的立体结构为
(3)E是非金属元素,其单质在电子工业中有重要应用。请写出工业生产单质E的化学方程式:
该反应中氧化剂与还原剂的质量比为
(4)由X、Q、R、F四种元素可形成两种中学常见化合物,写出它们在水溶液中加热时反应的离子方程式
17.(5分)高美华同学只用了一个圆底烧瓶、带玻璃管的橡皮塞、胶皮管、酒精灯、少量浓氨水、大烧杯及水做成了喷泉实验。请问:
①该同学应用了什么原理?
②用稀氨水是否也能做成这个实验?(填“能”或“不能”)
16.(10分)某学生利用以下装置制备氨气,并完成氨气的喷泉实验。请回答下列问题:
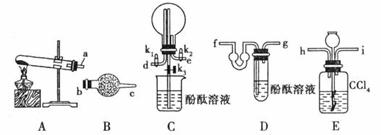
(1)装置A中发生反应的化学方程式
(2)装置B中所盛的试剂是
(3)如果将制备氨气和氨气的喷泉实验组合为一整套实验,用字母表示仪器接口的连接顺序:( )、( )、c、( )、( )、( )、( )、( )
(4)组装好装置,检查装置的气密性后,加入试剂,关闭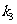 ,打开
,打开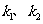 ,给A装置试管进行加热。当
,给A装置试管进行加热。当
(填写现象)时,即烧瓶中氨气收满。关闭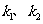 ,
(填写操作方法),一会儿可以看见烧瓶中出现喷泉现象。
,
(填写操作方法),一会儿可以看见烧瓶中出现喷泉现象。
(5)装置E的作用
(6)第(4)问中提到“组装好装置后,检查装置的气密性”,这一组装好的装置气密性检查的方法是 。
15.在一定温度下,向一个2L的真空密闭容器中(装有催化剂,500℃)通入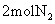 和
和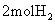 ,经过一段时间后,测得容器内气体的物质的量为起始时的0.9倍。已知在此段时间内以
,经过一段时间后,测得容器内气体的物质的量为起始时的0.9倍。已知在此段时间内以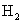 表示的平均反应速率为
表示的平均反应速率为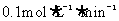 ,则所经过的时间为( )
,则所经过的时间为( )
A.1min B.2min C.3min D.6min
第Ⅱ卷 (非选择题 共55分)
非选择题,共6题。
14.下列离子方程式中,只能表示一个化学反应的是( )
①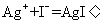
②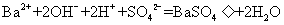
③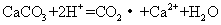
④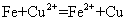
⑤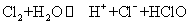
A.①③ B.只有⑤ C.②⑤ D.②④
13.实验室常采用点滴板来完成部分实验,既可节约药品,又便于观察实验现象。对如图所示的实验现象的描述正确的是( )
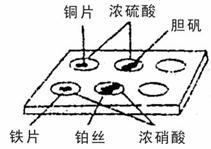
①装有铜片的孔穴中溶液呈蓝色; ②装有胆矾的孔穴中固体的颜色变浅;
③装有铁片的孔穴中溶液呈绿色; ④装有铁片的孔穴中溶液呈浅黄色;
⑤装有铂丝的孔穴中固体没有溶解;
A.①④ B.②③ C.①⑤ D.②⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com