
8.下图所示的原电池装置,观察到由电流表指针有明显偏转,下列说法中不正确的是
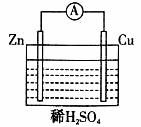
A.原电池装置能将化学能转变为电能
B.原电池的反应本质是氧化还原反应
C.锌失去电子发生还原反应,电子沿导线流向铜
D.铜片表面产生大量气泡
7.下列物质在一定条件下可与甲烷发生反应的是
A.氢氧化钠溶液 B.稀硫酸
C.氯气 D.酸性高锰酸钾溶液
6.下列物质中,既含有离子键又含有共价键的是
A.Na2O B.MgCl2 C.NaOH D.HCl
5.某元素最高价氧化物的水化物的化学式为H2XO4,该元素的气态氢化物的化学式是
A.HX B.H2X C.XH3 D.XH4
4.下列物质中,不属于合成材料的是
A.塑料 B.淀粉 C.合成纤维 D.合成橡胶
3.在元素周期表中,同主族元素的原子具有相同的
A.最外层电子数 B.核电荷数 C.电子层数 D.核外电子数
2.考古时利用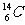 测定一些文物的年代。
测定一些文物的年代。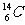 原子核内中子数是
原子核内中子数是
A.20 B.14 C.8 D.6
1.近年来,北京市大力推广沼气作为农村生活能源。沼气的主要成分是
A.甲烷 B.乙烷 C.乙烯 D.一氧化碳
22.(8分)高铁酸钾(K2FeO4)具有极高的氧化性,对环境无不良影响,被人们称为“绿色化学”试剂。某校化学兴趣小组对高铁酸钾进行了如下探究。
I、高铁酸钾制备:
①在一定温度下,将氯气通入KOH溶液中制得次氯酸钾溶液;
②在剧烈搅拌条件下,将Fe(NO3)3 分批加入次氯酸钾溶液中,控制反应温度,以免次氯酸钾分解;
③加KOH至饱和,使K2FeO4 充分析出,再经纯化得产品。
温度过高会导致次氯酸钾分解生成两种化合物,产物之一是氯酸钾(KClO3),此反应化学方程式是 。
II、探究高铁酸钾的某种性质:
[实验1]:将适量K2FeO4分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度均为 1.0mmol·L-1(1mmol·L-1=10-3mol·L-1)的试样,静置,考察不同初始 pH 的水溶液对K2FeO4某种性质的影响,结果见图1(注:800min后,三种溶液中高铁酸钾的浓度不再改变)。
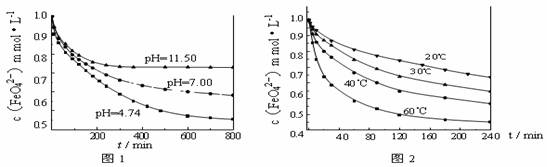
[实验2]:将适量 K2FeO4 溶解于pH=4.74 的水溶液中,配制成FeO42-浓度为 1.0mmol·L-1 的试样,将试样分别置于 20℃、30℃、40℃和 60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。
(1)实验1的目的是 ;
(2)实验2可得出的结论是 ;
(3)高铁酸钾在水中的反应为:4
FeO42-+10 H2O 4 Fe(OH)3 +8OH-+3
O2↑。
4 Fe(OH)3 +8OH-+3
O2↑。
由图1可知,800min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是 ;
21.(8分)实验室欲用下列装置和药品来制备少量的氮化镁(已知氮化镁容易与水反应)
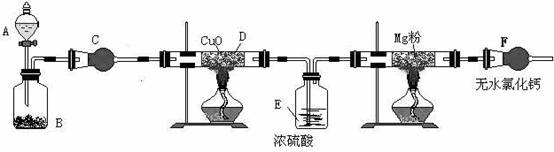
上图的实验装置中,A中是浓氨水,B中是生石灰,C中是干燥剂。已知氨气有还原性,能还原氧化铜,生成物之一是空气的主要成分。试通过分析回答:
(1)装置B中生石灰的作用是 ;
(2)装置C中应当选用的干燥剂是 ;
(3)装置E的作用是 ;
(4)如果没有装置F,可能发生的反应 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com