
1.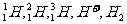 ,可以表示为(
)
,可以表示为(
)
A.氢的五种同位素 B.五种氢元素
C.化学性质不同的氢原子 D.氢元素的五种不同粒子
28.(10分)
有机物A由C、H、O三种元素组成,相对分子质量为90。充分燃烧0.1 mol A生成5.4 g水和0.3 mol CO2。请回答:
(1)A的分子式是 。
(2)A物质符合下列条件:
①A的水溶液可以使紫色石蕊试液变红;
②lmol A与足量碳酸氢钠溶液反应生成1 mol CO2;
③1mol A与足量的金属钠反应生成1 mol H2;
④A分子中有一个-CH3。
A分子中官能团的名称是 ;A的结构简式是 。
(3)等物质的量的A与乙酸在浓H2SO4作用下加热发生反应,其化学方程式为:
(4)有机物B与A互为同分异构体,且与A含有相同种类和数量的官能团,则B的结构简式是
27.(16分)
单质碘有非常重要的用途,它的制备一般有两种方法:
方法一:海带、海藻燃烧后所得的灰份中含I一,从中获得I一,由I一制备I2。
某研究性学习小组为了从海带中提取碘,设计并进行了以下实验:
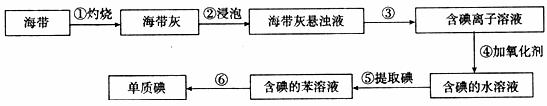
请回答:
(1)步骤①中灼烧海带时用到的实验仪器有坩埚钳、铁三脚架、泥三角、酒精灯和 (填字母)。
A.试管 B.瓷坩埚 C.烧杯 D.量筒
(2)步骤③的实验操作名称是 ;
(3)步骤④中氧化剂最好选用 (填字母)。
A.浓硫酸 B.新制氯水
C.酸性KMnO4溶液 D.3%H2O2与稀H2SO4混合液
其反应的离子方程式是
(4)步骤⑤中,学生选择用苯来提取碘,还可以用下列 (填字母)来提取碘。
A.乙酸 B.四氯化碳 C.酒精 D.己烷
(5)步骤⑤中,为了检验提取碘后的水溶液中是否还含有单质碘,取少量上述溶液于试管中,滴加 ,如果看到 ,则证明溶液中还含有碘。
(6)步骤⑤中为了得到含碘的苯溶液,某学生设计了以下操作步骤:
a.将含碘的水溶液置于分液漏斗中
b.加入适量的苯
c.分离出下层液体
d.分离出上层液体,即得到含碘的苯溶液
以上设计中有遗漏的操作。应该在步骤 (填字母)后,增加操作:
方法二:从智利硝石中获得碘酸钠(NaIO3),再用NaHSO3把碘酸钠还原为I2。实际生产中分两步进行:
第一步:先用适量的NaHSO3将碘酸钠(NaIO3)还原成I一,反应的离子方程式为:
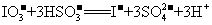
第二步:向所得的酸性I一溶液中加入适量的碘酸钠(NaIO3)溶液便有碘析出,反应的离子方程式为: 。
26.(14分)短周期元素T、Q、R、W、Z在元素周期表中的位置如下图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
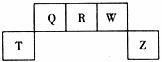
(1)Q的气态氢化物的分子式为 ,其分子的空间结构为 结构。
(2)Z元素比R元素的非金属性强。能证明这一结论的事实是 (填序号)。
①相同条件下,Z单质在水中的溶解性强于R单质
②Z的最高价氧化物的水化物酸性比R的强
③Z的氢化物比R的氢化物稳定
(3)向T、Z元素形成的化合物的溶液中逐滴加入NaOH溶液,先产生白色沉淀;继续滴加NaOH溶液,直至沉淀溶解。写出沉淀溶解的离子方程式:
(4)QW和RW都是汽车尾气中含有的大气污染物,它们在汽车排气管的“催化转换器”中反应生成可参与大气生态循环的无毒气体,化学方程式为 。
(5)M是一种常见的金属单质,与元素Z的单质有如下图所示转化关系:
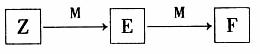
E在溶液中转化为F的离子方程式是 。
若把一定量的M放入E溶液中,完全反应后,所得溶液中E、F的物质的量相等,则已反应的E与未反应的E的物质的量之比为 。
25.(10分)
某同学探究外界条件对H2O2分解速率的影响,所用H2O2溶液浓度为5%、10%,实验温度为20℃、40℃,其他试剂有1 mol/L FeCl3溶液。每次实验H2O2溶液的用量为2 mL,FeCl3溶液2滴。
(1)请完成以下实验设计表:
|
实验 编号 |
温度/℃ |
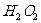 浓度/% 浓度/% |
其他试剂 |
实验目的 |
|
① |
20 |
5 |
无 |
实验①和②探究催化剂对分解速率的影响 实验②和③探究温度对该反应速率的影响 实验②和④探究溶液浓度对该反应速率的影响 |
|
② |
20 |
5 |
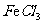 溶液 溶液 |
|
|
③ |
|
|
|
|
|
④ |
|
|
|
(2)实验④产生气泡的速率比实验②快。分析引起反应速率差异的原因是 。
(3)废旧印刷电路板的回收利用可实现资源再生。经粉碎分离,能得到非金属粉末和金属粉末。用H2O2和稀H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,溶液变成蓝色,写出发生反应的化学方程式:
控制其它条件相同,印刷电路板的金属粉末用10%H2O2溶液和3.0mol/LH2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
铜的平均溶解速率 (×10-3mol/(L·min) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是:
23.(10分)
海水是巨大的资源宝库,可以进行综合利用。从海水中提取食盐和溴的过程如下:
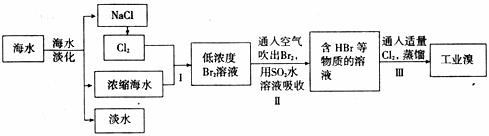
(1)请写出一种海水淡化的方法:
(2)步骤I获得Br2的离子方程式为 ;
(3)步骤II用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的。其反应的化学方程式为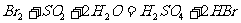 ,在该反应中,氧化剂是
,在该反应中,氧化剂是
(填化学式)。若反应中生成2 mol HBr,则消耗 mol SO2。
(4)根据上述反应判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是 。24.(14分)
I、以原油为原料生产聚乙烯的步骤如下:
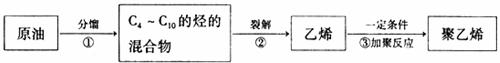
请回答:
(1)上述过程属于物理变化的是 (填序号)。
(2)聚乙烯塑料可以用来制造多种包装材料,聚乙烯的结构简式是 。
(3)将11.2 L(标准状况)乙烷和乙烯的混合气体通入足量的溴水中,充分反应后,溴水质量增加了5.6 g。溴水质量增加的原因(用化学方程式表示):
原混合气体中,乙烷与乙烯的物质的量之比是
II、实验室用上图所示装置制取乙酸乙酯。请回答:
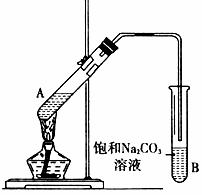
(1)在试管A中先加3 mL乙醇,然后边振荡边加入2 mL浓硫酸和2 mL乙酸,它们之间发生反应的化学方程式为:
(2)加热一段时间后,可以看到试管B的液面 (填“上”或“下”)有透明的、不溶于水的油状液体产生,并可以闻到香味。
(3)B试管中的导管不伸入液面下的原因是 (填序号)。
①防止溶液倒吸 ②避免反应过快
22.(12分)
下表是元素周期表的一部分。
族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
1 |
① |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
② |
|
③ |
④ |
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
|
4 |
⑨ |
|
|
|
|
|
|
|
用表中的①-⑨九种元素及其化合物,填写下列空白:
(1)②号元素的元素符号为 。
(2)非金属性最强的元素是 (填元素符号)。
(3)单质常用来做半导体材料的元素是 (填元素符号)。
(4)最高价氧化物的水化物中,碱性最强的是 (填化学式)。
(5)最高价氧化物是两性氧化物的是 (填化学式)。
(6)⑤、⑧两元素形成的化合物的电子式为 。
21.(4分)
某同学进行如下实验,检验化学反应中的能量变化。
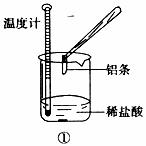
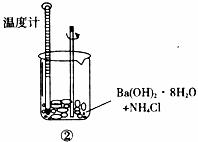
实验中发现反应前后①中的温度升高而②中的温度降低,由此判断Al与盐酸的反应是
热反应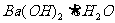 与NH4Cl的反应是
热反应。试写出①中反应的离子方程式:
。
与NH4Cl的反应是
热反应。试写出①中反应的离子方程式:
。
20.元素X、Y、Z均为短周期元素且原子序数之和为35,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
A.三种元素的原子序数Y>X>Z
B.三种元素的原子半径X>Y>Z
C.同周期元素中X的金属性最强
D.同周期元素中Y的最高价氧化物的水化物酸性最强
19.某学生用下图所示装置进行反应X+Y=Z能量变化情况的研究。当向盛有X的试管中滴加试剂Y时,看到U型管中甲处液面下降乙处液面上升。下列说法能正确解释该现象的是
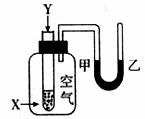
①反应为放热反应;
②生成物的总能量比反应物的总能量高;
③物质中的化学能通过化学反应转化成热能释放出来;
④反应物化学键断裂吸收的能量高于生成物化学键形成放出的能量。
A.①② B.①③ C.②③ D.②④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com