
9.汽车尾气净化中的一个反应如下:
NO(g)+CO(g)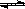 1/2N2(g)+CO2(g) △H=
1/2N2(g)+CO2(g) △H=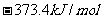
在恒容密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是
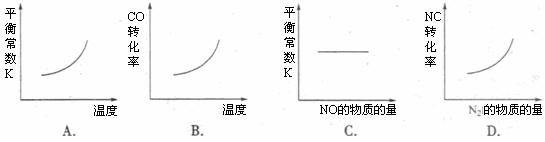
8.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如下图所示。有关a、b、c三点的下列说法中正确的是
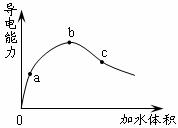
A.醋酸的电离程度由大到小的顺序:b>c>a
B.溶液的pH由大到小的顺序: a>c>b
C.用湿润的pH试纸测量醋酸溶液的pH,测量结果均偏大
D.与等浓度NaOH溶液中和,消耗NaOH溶液的体积b最多
7.T°C时,将体积为VAL、浓度为a mol/L的一元酸HA与体积为VBL、浓度为b mol/L的一元碱BOH混合,混合液恰好呈中性,则下列判断正确的是 ( )
A.混合液的pH=7 B.a=b
C.混合液中Kw=[c(H+)]2 D.a=b,VA=VB
6.在amL浓度为c mol·L-1的AgNO3溶液中加入一定体积的pH=1的盐酸时,恰好使溶液中Ag+完全沉淀,此时得到pH=2的溶液100 mL(设反应前后溶液体积变化忽略不计),则c的值是( )
A.0.0020 B.0.011 C.0.11 D.0.22
5.燃料电池是燃料(例如CO,H2,CH4等)跟氧气或空气起反应,将此反应的化学能转变为电能的装置,电解质通常是KOH溶液。下列关于甲烷燃料电池的说法不正确的是 ( )
A.负极反应式为:CH4+10OH--8e=CO32-+7H2O
B.正极反应式为:O2+2H2O+4e=4OH-
C.随着不断放电,电解质溶液碱性不变
D.甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大
4.下列溶液中有关微粒的物质的量浓度的比较正确的是 ( )
A.常温下两种溶液①0.1mol/L CH3COOH溶液 ②0.3mol/L CH3COOH溶液与0.1mol/LNaOH溶液等体积的混合液c(H+):①<②
B.常温下将NaHCO3与NaHSO3混合溶于水,恰好呈中性的溶液中:
c(Na+)= c(HCO3-)+c(HSO3-)+2c(CO32-)+2c(SO32-)
C.相同条件下,pH=9的①CH3COONa溶液、②NH3·H2O溶液、③NaOH溶液中,由水电离出的c(OH-):①>②>③
D.已知酸性HF>CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中:
[c(Na+)-c(F-)] >[c(K+)-c(CH3COO-)]
3.下列实验事实不能证明醋酸是弱酸的是 ( )
A.常温下,测得醋酸钠溶液的pH>7
B.常温下,测得0.1mol/L醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4
D.常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和
2.反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。下列叙述能表明反应达到平衡状态的是
( )
Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。下列叙述能表明反应达到平衡状态的是
( )
A.气体的密度不再改变
B.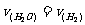
C.容器内压强不再改变 D.反应不再进行
1.有关下列各组热化学方程式中关系说法正确的是 ( )
2H2(g)+O2(g)=2H2O(g); △H1 = -Q1kJ/mol
2H2(g)+O2(g)=2H2O(1); △H2 = -Q2kJ/mol
H2(g)+1/2O2(g)=H2O(1); △H3 = -Q3kJ/mol
A.△H1=△H2 B.△H1<△H2
C.Q1 >2Q3 D.△H1>2△H3
22.(10分)取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:
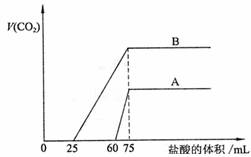
(1)曲线A表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式)
,各种溶质的物质的量之比为 ;加盐酸后产生CO2体积的最大值为 mL。
(2)曲线B表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式) ;加盐酸后产生CO2体积最大值 mL。
(3)通过计算求出原NaOH溶液的物质的量浓度。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com