
12.铁溶于一定浓度的硝酸溶液时,发生的离子反应方程式为
a Fe + b NO3- + c H+ = d Fe2+ + f Fe3+ + g NO↑ + h N2O↑ + k H2O
下列有关推断中不正确的是 ( )
A.2d + 3f = 3g+h
B.反应中每消耗5.6gFe,转移0.2mol~0.3mole-+
C.HNO3氧化性大于Fe3+
D.当a不变时,d随b的增大而增大
11.下列叙述正确的是 ( )
A.在原电池的负极和电解池的阴极上都发生失电子的氧化反应
B.在惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量的比为1:2
C.用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1molNaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
10.在100ml 0.2mol/L的NH3·H2O中,欲使NH3·H2O的pH变小,可以采用的方法是
( )
①加热至沸腾 ②加少量NaOH
③加100mL水 ④加20ml 0.2mol/L的NH3·H2O
A.①③④ B.①③ C.②③ D.②
9.下图为周期表中短周期的一部分,若a原子最外层电子数比次外层电子数少3个,下列说法中不正确的是( )
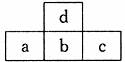
A.原子半径大小的顺序:c>b>d>a
B.d的氢化物比a的氢化物稳定
C.a和d的原子结合可以形成带有3个负电荷的阴离子
D.a、b、c最高价氧化物对应的水化物的酸性强弱关系是:c>b>a
8.某氯原子的质量是ag,12C原子的质量是bg,用NA表示阿伏加德罗常数,下列说法中正确的是 ( )
①氯元素的相对原子质量一定是12a/b
②mg该氯原子的物质的量一定是 m /(aNA)mol
③该氯原子的摩尔质量是aNA g/mol
④ag该氯原子所含质子数是17mol
A.①③ B.②④ C.①④ D.②③
7.下列说法正确的是 ( )
A.淀粉和纤维素的组成都可以用(C6H10O5)n来表示,它们互为同分异构体
B.CH2=CHC(CH3)3与氢气完全加成后,生成物的名称是3,3-二基甲丁烷
C.CS2的结构式为S=C=S
D.-CH3(甲基)的电子式为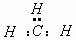
6.下列物质一定属于混合物的是 ( )
①冰、水混合物 ②红磷与白磷的混合物 ③不含杂质的盐酸 ④KAl(SO4)2·12H2O
⑤氯水 ⑥玛瑙 ⑦纯净的磷酸 ⑧天然油脂 ⑨分子式为C5H12的有机物

 ⑩“水立方”建筑使用的膜材料 [ CH2-CH2-CF2-CF2 ]n
⑩“水立方”建筑使用的膜材料 [ CH2-CH2-CF2-CF2 ]n
A.②③⑤⑥⑧⑩ B.①②④⑥⑦⑨
C.全部 D.以上答案均不合题意
28.下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 10.00%的K2SO4溶液、足量的CuSO4溶液、100mL AlCl3和Cu(NO3)2的混合溶液,乙中其中一个电极为锌电极,其余均为石墨电极。一段时间后,e电极质量增加。理论上丙中两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积)。据此回答下列问题:
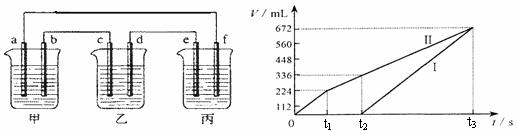
(1)a为 极,d的电极材料为 。(2分)
(2)电极b的电极反应式为 ,t3时甲中溶液的质量分数为 。(4分)
(3)原混合溶液中Cu(NO3)2的物质的量浓度是 。(2分)
(4)丙溶液在t2-t3时间内,pH值的变化情况为 (填“增大”“减小”或“不变”),此段时间内发生反应的方程式为 。(2分)
(5)计算:①t2时所得溶液的pH;②电解至t3时,丙中消耗水的质量。(6分)
27.A、B、C、D、E、F、G、H是元素周期表中前四个周期的八种元素。已知A、C、E、G、H的基态原子中未成对电子数与其所在的周期序数相同,B与H同族,D、H、F 同一周期且原子序数依次增大,A与B的原子核外电子数之和与C原子的核外电子数相等且A、B、C能形成离子化合物,D原子的电子层数与价电子数相等但只有1个未成对电子,E的价电子数是G 的两倍,F原子的最外层也只有1个未成对电子。
(1)B、C、D、H四种元素的第一电离能由大到小的顺序为_____________________,电负性由小到大的顺序为____________________,B、F、G、H的最高价氧化物的水化物的酸性由强到弱的顺序为___________________________________(用化学式表示)。(3分)
(2)A、B、C形成的此化合物受热时发生反应的类型为__________(填序号)。(2分)
A.化合反应 B.分解反应 C.置换反应 D.氧化还原反应
(3)等质量的D的单质分别与足量的盐酸和氢氧化钠溶液反应放出的气体在常温常压下的体积比为__________,将所得溶液混合时含有D元素的两种物质间发生反应的离子方程式为___________________________________________________。(4分)
(4)G的最高价含氧酸的钠盐中属于酸式盐的一种的水溶液显________性,其原因是_______________________________________________________(用必要的离子方程式和文字说明),溶液中离子浓度大小的顺序为______________________。(5分)
(5)将E 与G的单质用导线连接同时插入氯化钠溶液中构成的原电池的总反应为_________________________________。E单质在常温下遇到A、B、C形成的另一化合物的浓溶液发生钝化现象,请写出过量的E 单质在此化合物的稀溶液中发生反应的离子方程式____________________________。E3+与E2+的稳定性大小为____
______,E3+的基态电子排布式为_______________,在下图的方框内画出E的基态原子的轨道表示式。(8分)

26.现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)。
Ⅰ.实验步骤:
(1)用___________________(填仪器名称,下同)量取10.00mL食用白醋,在_________中用水稀释后转移到100mL__________中定容,摇匀即得待测白醋溶液。(3分)
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,并滴加2滴 作指示剂。(1分)
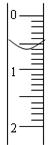
(3)读取盛装0.1000 mol/L NaOH 溶液的碱式滴定管的初始读数。如果液面位置如下图所示,则此时的读数为 。(1分)
(4)滴定:当 时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。(2分)
Ⅱ.实验记录:
|
滴定次数 |
1 |
2 |
3 |
4 |
|
V(样品)(mL) |
20.00 |
20.00 |
20.00 |
20.00 |
|
V(NaOH)(消耗)(mL) |
15.95 |
15.00 |
15.05 |
14.95 |
Ⅲ.数据处理与讨论:
(1)计算可得c(市售白醋)= ,市售白醋总酸量= g/100mL。(2分)
(2)某同学仔细研究了该品牌白醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想确定醋酸与苯甲酸钠是否发生反应,需查找在一定温度下的 (填序号)。(1分)
A.pH B.电离度 C.电离常数 D.溶解度
(3)在本实验的滴定过程中,下列操作会使实验结果偏大的是 (填序号)。(2分)
A.碱式滴定管在滴定时未用标准NaOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com