
3.下列叙述中正确的是 ( )
A.P4和NO2都是共价化合物
B.NaCl熔化时离子键断裂属于化学变化
C.在CaO和SiO2晶体中,都不存在单个小分子
D.石墨转变为金刚石,属于物理变化
2.决定溶液、胶体和悬浊液这三种分散系性质的本质原因是 ( )
A.是否为大量分子或离子的集合体 B.能否透过滤纸或半透膜
C.分散质粒子的大小 D.能否产生丁达尔现象
1.实现下列变化时,克服微粒间作用力类型相同的是 ( )
A.二氧化硅和干冰的熔化 B.液溴和液氨的气化
C.食盐和冰的熔化 D.纯碱和金属钠的熔化
30.(Ⅰ)(8分)已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2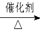 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
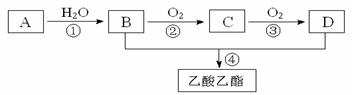
回答下列问题:
(1)写出A的电子式 。
(2)写出下列反应的反应类型:① ___ ,④ 。
(3)写出下列反应的化学方程式:
① ;
② 。
(Ⅱ)(12分)下图是制备乙酸乙酯的装置图,在左试管中先加入2mL95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2 mL乙酸,充分摇匀。在右试管中加入5mL饱和Na2CO3溶液。按图连接好装置,用酒精灯对左试管小火加热3-5min后,改用大火加热,当观察到右试管中有明显现象时停止实验。
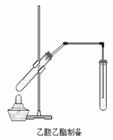
(1)写出左试管中主要反应的化学方程式:_______________________________________;(2)加入浓硫酸的作用:_______________________________________________;
(3)饱和Na2CO3溶液的作用是: _____________________________________________;
(4)反应开始时用酒精灯对左试管小火加热的原因是:_________________________ ______;(已知乙酸乙酯的沸点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃)
(5)分离右试管中所得乙酸乙酯和Na2CO3溶液的操作为(只填名称) ,所需主要仪器为 。
(6)实验生成的乙酸乙酯,其密度比水 ,有 气味。
29.(19分)有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2。E的阳离子与A的阴离子核外电子层结构完全相同。回答下列问题:
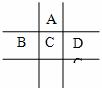
(1)五种元素的名称:A__________,B______________, C____________,D__________,E______________。
(2)B、C、D元素的原子半径由大到小的顺序为 ___________________,
它们的最高价氧化物对应水化物的酸性强弱顺序为___________________。
(3)写出C单质在足量A单质中燃烧后的产物与D单质同时通入水中的化学方程式_____________________________________________。
(4)A与E形成的化合物的化学式是______________,它的性质决定了它在物质的分类中应属于______________。
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量时,观察到的现象是_______________________ ,
有关反应的离子方程式为_________________________________________________
______________________________________________________。
28.(7分)将一定量的A、B、C三种物质(都是气体)放入固定体积为10 L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的物质的量变化如下图所示。
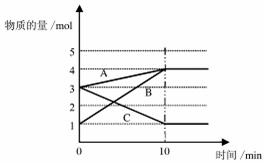
请解答下列问题:
(1)反应的化学方程式用A、B、C可表示为 __ 。
(2)用B的浓度变化表示在0~10 min内的反应速率是 _ 。
(3)不能判断该反应达到化学平衡状态的标志是 __ 。(填字母)
a.A和B浓度相等 b.A百分含量保持不变
c.A的生成速率与B的消耗速率相等 d.容器中气体的压强不变
e.容器中混合气体的密度保持不变
27.将1mol N2和3 mol H2通入4L的密闭容器中反应,半分钟后测得H2的物质的量为2.1 mol,现用如下三种物质在单位时间内的浓度变化来表示该反应速率。
① v(N2) = 0.15 mol/(L·min) ② v(H2) = 1.05 mol/(L·min)
③ v(NH3) = 0.30 mol/(L·min) 其中正确的是
A.①② B.②③ C.①③ D.①②③
26.在反应:C(s) + CO2(g)  2CO(g)中,可使反应速率增大的措施是:
2CO(g)中,可使反应速率增大的措施是:
①增大压强 ②升高温度 ③通入CO2 ④增加碳的量 ⑤降低压强
A.①②③ B.②③④⑤ C.①②③④ D.②③④
25.下列各组物质,不管以何种比例混合,只要总物质的量一定,完全燃烧消耗氧气的量也一定的是
A.CH4与C2H4 B.C2H6与CH3CH2OH
C.CO和H2 D.C2H4与C6H6
24.在一定温度和催化剂条件下,某一密闭容器内发生可逆反应:2A(g) + B(s)  2C(g),下列有关叙述中错误的是
2C(g),下列有关叙述中错误的是
A.达到平衡状态时,c[A(g)]和c[C(g)]一定相等
B.在上述条件下,A(g) 不可能100%地转化为C(g)
C.将块状的B改为粉末能使反应速率加快
D.使用合适的催化剂是为了提高生产的效率
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com