
23.(14分)某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
Ⅰ.本制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体 g。
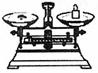
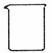
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母): 。
|
名称 |
托盘天平(带砝码) |
小烧杯 |
坩埚钳 |
玻璃棒 |
药匙 |
量筒 |
|
仪器 |
 |
 |
 |
 |
 |
 |
|
序号 |
a |
b |
c |
d |
e |
f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。
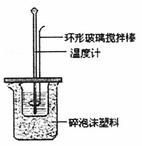
(1)写出该反应的热化学方程式(中和热为57.3KJ/mol): 。
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
|
温度 实验次数 |
起始温度t1/℃ |
终止温度 t2/℃ |
平均温度差值 (t2- t1)/℃ |
||
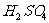 |
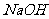 |
平均值 |
|||
|
1 |
26.2 |
26.0 |
26.1 |
30.1 |
|
|
2 |
27.0 |
27.4 |
27.2 |
33.3 |
|
|
3 |
25.9 |
25.9 |
25.9 |
29.8 |
|
|
4 |
26.4 |
26.2 |
26.3 |
30.4 |
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是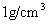 ,中和后生成溶液的比热容
,中和后生成溶液的比热容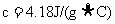 。则中和热
。则中和热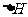 =
(取小数点后一位)。
=
(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
22.(16分)U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在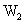 中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物
中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物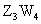 具有磁性。U的单质在
具有磁性。U的单质在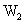 中燃烧可生成UW和
中燃烧可生成UW和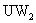 两种气体。X的单质是一种金属,该金属在
两种气体。X的单质是一种金属,该金属在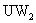 中剧烈燃烧生成黑、白两种固体。
中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为 ;XW的电子式为 ;Z元素在周期表中的位置是 。
(2)U元素形成的同素异形体的晶体类型可能是(填序号) 。
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)
;V、W的氢化物分子结合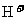 能力较强的是(写化学式)
。
能力较强的是(写化学式)
。
(4)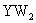 气体通入
气体通入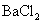 和
和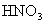 的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为
。
的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为
。
由此可知VW和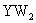 还原性较强的是(写化学式)
。
还原性较强的是(写化学式)
。
21.(15分)现有几种离子
|
阳离子 |
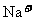 、 、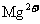 、 、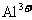 、 、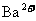 、 、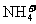 |
|
阴离子 |
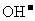 、 、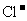 、 、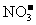 、 、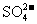 、 、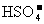 |
A、B、C、D、E是由它们组成的五种可溶于水的固体(每种离子只能用一次),分别取它们进行实验,结果如下:
①将D与E的溶液混合加热,产生有刺激性气味的气体
②将B与E的溶液混合,产生白色沉淀,向该沉淀中加入足量的稀硝酸,沉淀部分溶解
③向一定量的E溶液中逐滴加入C溶液,先无明显现象,后来产生白色沉淀,且该沉淀可溶于A溶液
④D固体在一定条件下可以分解为水和另外两种气体单质
(1)根据以上条件推断并写出下列物质的化学式:
A B C D E
(2)写出A溶液与E溶液恰好完全反应至溶液呈中性的离子方程式:
(3)若1gD固体在一定温度下分解生成水蒸气时放热1.49KJ的热量,写出该反应的热化学方程式 。
20.今有一混合物的水溶液,只可能含有以下离子中的若干种: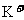 、
、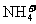 、
、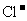 、
、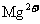
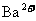 、
、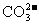 、
、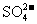 ,现取三份100mL溶液进行如下实验: ( )
,现取三份100mL溶液进行如下实验: ( )
(1)第一份加入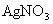 溶液有沉淀产生
溶液有沉淀产生
(2)第二份加足量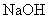 溶液加热后,收集到气体0.04mol
溶液加热后,收集到气体0.04mol
(3)第三份加足量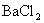 溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是
溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是
A.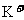 一定存在 B.100mL溶液中含
一定存在 B.100mL溶液中含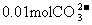
C.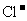 一定存在 D.
一定存在 D.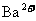 一定不存在,
一定不存在,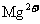 可能存在
可能存在
第Ⅱ卷(非选择题,共60分)
19.根据测定硫酸铜晶体结晶水含量的实验,判断下列操作导致测定结果偏小的是( )
A.加热前称量时容器未完全干燥
B.加热过程中有少量物质溅失
C.加热后容器未放入干燥器中中冷却
D.最后两次加热后质量相差较大(大于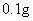 )
)
18.在硫酸的工业生产中,下列生产操作及对生产操作主要原因的说明二者都正确的是
( )
A.从沸腾炉出来的炉气需净化,因为炉气中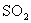 会与杂质反应
会与杂质反应
B.硫铁矿燃烧前需要粉碎,因为大块的不能燃烧
C.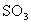 用98.3%的浓
用98.3%的浓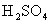 吸收,目的是防止形成酸雾,以使
吸收,目的是防止形成酸雾,以使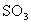 吸收完全
吸收完全
D.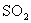 氧化为
氧化为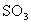 时需使用催化剂,这样可以提高
时需使用催化剂,这样可以提高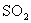 的转化率
的转化率
17.某同学按图所示的装置进行电解实验。下列说法正确的是 ( )
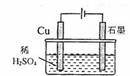
A.电解过程中,铜电极上有H2产生
B.电解初期,主反应方程式为:
C.电解一段时间后,石墨电极上有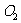 产生
产生
D.整个电解过程中,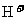 的浓度不断增大
的浓度不断增大
16.下列说法中正确的是 ( )
A.在相同条件下,若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨)=C(金刚石)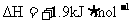 ”可知,金刚石比石墨稳定
”可知,金刚石比石墨稳定
C.在稀溶液中: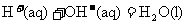 ;
;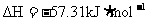 ,若将含
,若将含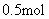
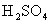 的浓硫酸与
的浓硫酸与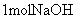 溶液混合,放出的热量大于57.31kJ
溶液混合,放出的热量大于57.31kJ
D.在101Kpa时,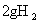 完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:
完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为: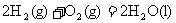 ;
;
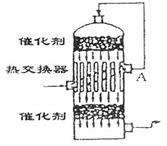
15.在硫酸工业生产中,为了有利于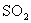 的转化,且能充分利用热能,采用了中间有热交换器的接触室(见图),按此密闭体系中气流的流向则A处流出的气体为 ( )
的转化,且能充分利用热能,采用了中间有热交换器的接触室(见图),按此密闭体系中气流的流向则A处流出的气体为 ( )
A.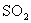 B.
B.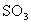 、
、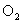 C.
C.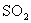 、
、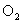 D.
D.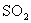 、
、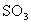
14.根据下表信息,下列叙述中正确的是 ( )
|
序号 |
氧化剂 |
还原剂 |
其他反应物 |
氧化产物 |
还原产物 |
|
① |
Cl2 |
FeBr2 |
|
|
Cl- |
|
② |
KMnO4 |
H2O2 |
H2SO4 |
O2 |
Mn2+ |
|
③ |
KClO3 |
浓盐酸 |
|
Cl2 |
Cl2 |
|
④ |
KMnO4 |
浓盐酸 |
|
Cl2 |
Mn2+ |
A.第①组反应中的氧化产物一定只有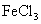
B.氧化性强弱比较: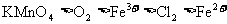
C.还原性强弱比较: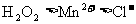
D.④的离子方程式配平后,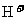 的化学计量数为16
的化学计量数为16
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com