
3.物质的下列用途与它的化学性质无关的是 ( )
A.用钠制取过氧化钠 B.用氯气制盐酸
C.用钠冶炼金属钛 D.高压钠灯
2.下列叙述正确的是 ( )
A.标准状况下,1 mol 水所占有的体积是22.4 L
B.1mol Na2SO4溶于水中,所得溶液中Na+个数为NA
C.1 mol 任何气体的体积都约为22.4 L
D.标准状况下,22.4 L的任何气体的物质的量都约是1 mol
1.首次将量子化概念应用到原子结构,并解释了原子稳定性的科学家是 ( )
A.道尔顿 B.汤姆生 C.卢瑟福 D.玻尔
29.(13分)铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究。填写下列空白。
[探究一] 实验方案:铝镁合金  测定剩余固体质量
测定剩余固体质量
实验中发生反应的化学方程式是
实验步骤:
(1)称取5.4g铝镁合金粉末样品,投入VmL 2.0mol·L-1NaOH溶液中,充分反应。NaOH溶液的体积V≥
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将 (填“偏高”或“偏低”)
[探究二] 实验方案:铝镁合金 测定生成气体的体积
测定生成气体的体积
实验装置如下图,问题讨论:
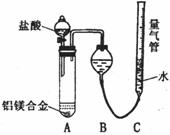
(3)某同学提出该实验装置不够完善,应在A、B之间添加一个干燥、除酸雾的装置。你的意见是: (填“需要”或“不需要”)。
(4)为使测定结果尽可能精确,实验中应注意的问题是(写出两点):
①
②
28.(11分)有一澄清透明的溶液,可能有NH4+、Fe3+、H+、Mg2+、Al3+、I-、CO32-等离子,现分别取溶液进行下列实验:
(1)加入浓溴水,溶液变为褐色;
(2)加入淀粉,未见蓝色;
(3)在逐滴加入1mol·L-1NaOH溶液的过程中,未闻到刺激性气体,随NaOH溶液的滴入,产生沉淀的量如图所示,试确定:
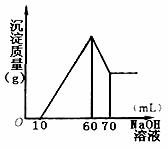
①溶液中一定存在的离子有 ;
②写出加入NaOH溶液过程中发生的反应的离子方程式
③其中阳离子物质的量分别为
27.(11分)某化学兴趣小组为探索工业废料的再利用,在实验室中用含有铝、铁、铜的合金制取氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体。其实验方案如下:
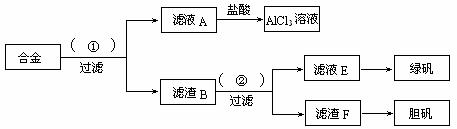
(1)所加试剂①、②分别是 。
(2)从滤液E中得到绿矾晶体的实验操作是:在隔绝空气的条件下, ;从滤渣F制取胆矾的第一步操作最好采用 。
(3)上述实验方案中,有一步设计明显不合理,请你予以指出,并说明理由 。
你认为正确的设计方案是
。
26.(15分)W、X、Y、Z是原子序数依次增大的同一短周期元素,W是金属元素,X是地壳中含量最多的金属元素,且w、x的最高价氧化物的水化物相互反应生成盐和水;Y、Z是非金属元素,Y与W可形成离子化合物W2Y;G在Y的前一周期,其原子最外层比Y原子最外层少一个电子。
(1)X的原子结构示意图为 。
(2)W、X的最高价氧化物的水化物相互反应的离子方程式为 。
(3)工业上制取X单质的化学方程式为 。
(4)G的气态氢化物与Y的最高价氧化物的水化物恰好反应生成的正盐的化学方程式为 。在催化剂作用下,汽车尾气中G的氧化物GO与一氧化碳两种气体能相互反应转化为无污染、能参与大气循环的两种气体,写出有关反应的化学方程式 ;若有33.6 L(已换算成标准状况)一氧化碳参加反应,转移的电子数为 。
(5)298K时,Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到Z的最高价氧化物的水化物的稀溶液,并放出a kJ的热量。该反应的热化学方程式为
(6)说出Z单质的一种用途______ ___
25.设计下列实验方案鉴别Na2CO3和NaHCO3两种白色粉末,不能达到预期目的的是 ( )
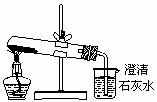
A.分别向等量的白色粉末中加等体积、等浓度的稀盐酸,比较生成气体的快慢
B.分别向等量的白色粉末中加等体积适量的水,比较固体溶解量的多少
C.分别将等量的白色粉末配成溶液,然后加入澄清石灰水,比较是否有沉淀生成
D.分别将等量的白色粉末用上图装置进行实验,比较澄清石灰水是否变混浊
第Ⅱ卷(非选择题,共50分)
24.向含有0.078molFeCl2的溶液中通入0.009molCl2,再向其中加入含0.01molX2O72-的酸性溶液,使溶液中的Fe2+恰好完全被氧化,且X2O72-被还原为Xn+,则n值为( )
A.2 B.3 C.4 D.5
23.在Fe2(SO4)3溶液中,加入ag铜,完全溶解后,再加bg铁,充分反应后得到cg残余固体,且a>c,则下列说法正确的是 ( )
A.残余固体是铜和铁
B.最后得到的溶液中一定含有Cu2+
C.将残余固体加入到稀H2SO4中,有气泡产生
D.最后得到的溶液中可能含有Fe3+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com