
2.将等物质的量的镁和铝相混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是 ( )
A.3 mol·L-1HCl B.4 mol·L-1HNO3
C.3mol·L-1NaOH D.18 mol·L-1H2SO4
1.下列关于环境问题的说法不正确的是 ( )
A.在燃煤中加入CaO可以减少SO2的排放
B.“白色污染”的发生说明有些合成材料的废弃物会造成严重的环境问题
C.pH在5.6-7.0之间的降水通常称为酸雨
D.废旧电池渗出的重金属离子会造成地下水和土壤的污染
31.硫化钠是用于皮革鞣质的重要化学制剂,可用无水芒硝(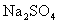 )与碳粉在高温下反应而制得。化学反应方程式如下:
)与碳粉在高温下反应而制得。化学反应方程式如下:
①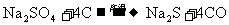
②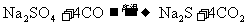
(1)现要制取Na2S 15.6g,需芒硝(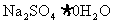 )
)
(2)①若在反应过程中,产生CO、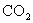 混合气体的体积为44.8L(标准状况),生成
混合气体的体积为44.8L(标准状况),生成
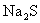 物质的量(n mol)范围是
<n<
。
物质的量(n mol)范围是
<n<
。
②若在上述反应中生成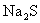 质量为62.4g,此时CO、CO2气体的体积为44.8L,则混合气体中CO、CO2的体积比是多少?
质量为62.4g,此时CO、CO2气体的体积为44.8L,则混合气体中CO、CO2的体积比是多少?
计算过程:
(3)硫化钠放置在空气中,会缓慢氧化成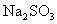 和
和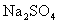 。现称取在空气中已部分被氧化的硫化钠39.2g溶于水中,加入足量用盐酸,充分反应后,过滤得沉淀9.6g,放出
。现称取在空气中已部分被氧化的硫化钠39.2g溶于水中,加入足量用盐酸,充分反应后,过滤得沉淀9.6g,放出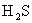 气体1.12L(标准状况),求39.2g被部分氧化的硫化钠中
气体1.12L(标准状况),求39.2g被部分氧化的硫化钠中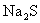 的物质的量为
mol;
的物质的量为
mol;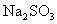 的物质的量为
mol;
的物质的量为
mol;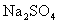 的物质的量为
mol。
的物质的量为
mol。
30.用沉淀法测定NaHCO3和K2CO3均匀混合物的组成。实验中每次称取样品的质量,向所配溶液中加入的Ba(OH)2溶液的体积、生成对应沉淀的质量等实验数据如下表所示。
|
实验序号 |
1 |
2 |
3 |
4 |
5 |
|
样品质量/g |
a |
2a |
2.574 |
4a |
5a |
|
V[Ba(OH)2(aq)]/L |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
|
沉淀质量/g |
b |
2.758 |
3b |
4b |
4b |
试完成下列问题:
(1)b= g。
(2)样品中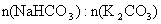 =
。
=
。
(3)25℃时,取第3次实验后的滤液的1/10.加水稀释至500 mL,试计算所得溶液的pH。
29.已知一个碳原子上连有两个羟基时,易发生下列转化:
请根据下图回答:
(1)E中含有的官能团名称是 ;③的反应类型是 ,C跟新制的氢氧化铜反应的化学方程式 。
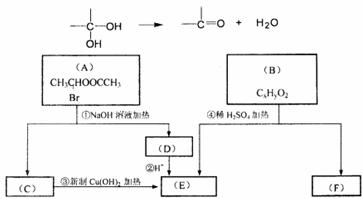
(2)在化学上某些分子的式量可以辅助我们推断该分子组成,已知B(CxHyO2)分子的相对式量为162,则B的分子式为 。
(3)在电脑芯片生产领域,高分子光阻剂是光刻蚀0.11 m线宽芯片的关键技术。B分子
m线宽芯片的关键技术。B分子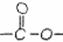 断键水解生成E、F,F就是生产这种高分子光阻剂的主要原料。F具有如下特点:①能跟FeCl3溶液发生显色反应:②能发生加聚反应;③苯环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式:
。
断键水解生成E、F,F就是生产这种高分子光阻剂的主要原料。F具有如下特点:①能跟FeCl3溶液发生显色反应:②能发生加聚反应;③苯环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式:
。
(4)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应。G可能有
种结构,写出其中不含甲基的同分异构体的结构简式: 。
28.有机物A的结构简式是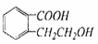 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质:
B.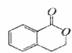 C
C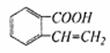 D.
D.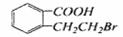
(1)A中官能团的名称是: 。
(2)写出由A制取B的化学方程式: 。
(3)写出A制取C、D两种物质的有机反应类型:C: D:
(4)写出两种既可以看做酯类又可以看做酚类,且分子中苯环上连有三种取代基的A的同分异构体的结构简式是 、 (要求这两种同分异构体中苯环上的取代甚至至少有一种不同)。
27.在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液。并置于水浴中;
③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;
④的试管里加有紫色石蕊试液; ⑤为尾气吸收装置。
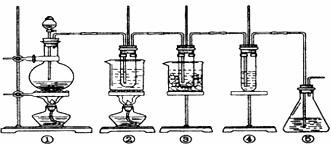
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰。通过 (填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气氢气体,可在①与②之间安装盛有 (填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:
反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是
(填写编号字母);从②的试管中分离出该晶体的方法是 (填写实验操作名称);
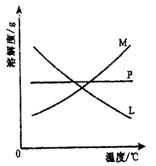
(3)本实验中制取次氯酸钠的离子方程式是: 。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
|
实验现象 |
原因 |
|
溶液最初从紫色逐渐变为
色 |
氯气与水反应生成的H+使石蕊变色 |
|
随后溶液逐渐变为无色 |
|
|
然后溶液从无色逐渐变为
色 |
|
26.某化学课外兴趣小组探究铜与浓硫酸的反应情况。甲、乙、丙三位同学进行了下列实验:取12.8g铜片和20ml、18 mol/L的浓硫酸放在圆底烧瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余外,同时根据所学的知识认为还有较多的硫酸剩余。
(1)请写出铜跟浓硫酸反应的化学方程式: 。
试问:为什么较多的余酸不再与铜片继续反应 。
可以证明有余酸的实验方案是 (填写字母,错选或多选扣分)。
(a)再加入铁粉 (b)再滴入BaCl2溶液
(c)再加入银粉 (d)再滴入Na2CO3溶液
(2)甲同学设计求余酸浓度的实验方案是测定产生气体的量。其方法有多种,请问下列方案中不可行的是 (填写字母,错选或多选扣分)。
(a)将产生的气体缓缓通过预先称量盛有碱石灰的干燥管,结束反应后再次称量。
(b)将产生的气体缓缓通入酸性高锰酸钾溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀。
(c)用排水法测定其产生气体的体积(折算成标准状况)。
(d)用排饱和NaHSO3溶液的方法测出其产生气体的体积(折算成标准状况)。
(3)乙同学设计测定余酸浓度的实验方案是:测定反应后的混合液中Cu2+的量。在反应后的溶液中加蒸馏水稀释至100 ml,加入足量Na2S溶液,充分反应后,过滤、洗涤、干燥、称量沉淀。请写出生成沉淀的离子方程式: 。
(4)根据甲、乙两同学的实验方案,除测算产生气体的物质的量或反应掉的铜的物质的量外,尚缺少的测量数据是 。
(5)丙同学提出甲、乙两同学的实验方案设计的复杂,为此他设计了下列较为简易的实验方案:取出反应后的铜片,进行洗涤、干燥、称量。若称得剩余铜片的质量为Wg,测得反应后溶液的体积为V ml,请计算剩余硫酸的物质的量浓度=
mol/L(用含W、V的代数式表示)。
25.在一容器为2升的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2+3H2 2NH3(g)+Q(Q>0)反应中NH3的物质的量浓度为变化的情况如下图:
2NH3(g)+Q(Q>0)反应中NH3的物质的量浓度为变化的情况如下图:
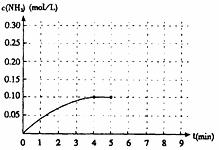
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(NH3)为 。
(2)该反应的化学平衡常数表达式为 。
(3)反应达到平衡后,等5分钟时,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为 (填序号)。
A.0.20 mol/L B.0.16 mol/L C.0.10 mol/L D.0.05 mol/L
(4)反应达到平衡后,第5分钟时,保持其它条件不变,若只把容器的体积缩小一半,平衡 移动(填“向左”、“向右”或“不”),化学平衡常数K (填“增大”、“减小”或“不变”)。
(5)若在第8分钟达到新的平衡(此时NH3的浓度约为0.25 mol/L),请在上图中画出第5分钟到此平衡时NH3浓度的变化曲线。
24.某一反应体系中有反应物和生成物共6种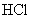 、
、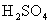 、
、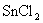 、
、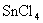 、
、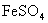 、
、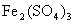 ,在反应后的溶液中滴加KSCN溶液不显红色。
,在反应后的溶液中滴加KSCN溶液不显红色。
(1)该反应中,被氧化的元素是 ,氧化剂是 。
(2)在该反应中,发生氧化反应的过程是 → 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目:
。
(4)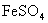 可用于制墨水、颜料、补血剂等,它易被氧化。
可用于制墨水、颜料、补血剂等,它易被氧化。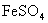 遇
遇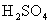 (浓)、
(浓)、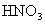 时反应的产物是
时反应的产物是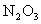 、
、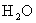 、
、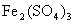 ,则该反应中还原剂与氧化剂的物质的量之比为
。
,则该反应中还原剂与氧化剂的物质的量之比为
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com