
1.设全集U是实数集R,,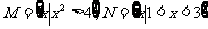 则图中阴影部分所表示的集合是( )
则图中阴影部分所表示的集合是( )
A.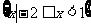 B.
B.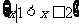 C.
C.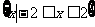 D.
D.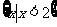
26.已知H2B在水溶液中存在以下电离:
一级电离:H2B H++HB-,二级电离:HB- H++B2- 请回答以下问题:
(1)NaHB溶液 (填“呈酸性”、“呈碱性”或“无法确定”),原因是
。
(2)若0.1mol·L-1的H2B溶液在某温度下的pH=3,c(B2-)=1×10-6mol·L-1,则H2B的一级电离的电离度约为 。
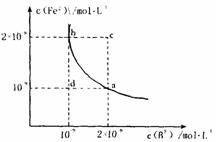 (3)某温度下,FeB(s) Fe2+(aq)+B2-(aq)
(3)某温度下,FeB(s) Fe2+(aq)+B2-(aq)
FeB在水中的沉淀溶解平衡曲线如右图所示。
下列说法错误的是
A.a点对应的KSP等于b点对应的KSP
B.d点无沉淀生成
C.可以通过升温实现由c点变到a点
D.此温度下,KSP=4×10-18
25.某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为两者反应生成只有CuCO3一种沉淀;
乙同学认为这两者相互促进水解反应,生成Cu(OH)2一种沉淀;
丙同学认为生成CuCO3和Cu(OH)2两种沉淀。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.按照乙同学得理解Na2CO3溶液和CuSO4溶液反应的化学反应方程式为 ;
在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为①过滤②洗涤③干燥。Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。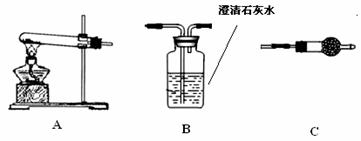
(1)各装置连接顺序(从左到右)为
(2)装置C中装有试剂的名称是 。
(3)能证明生成物中有CuCO3的实验现象是 。
Ⅲ.若CuCO3和Cu(OH)2两者都有,可通过下列所示装置进行定量分析来测定其组成。
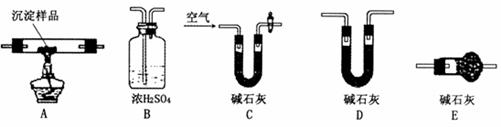
(1)各装置连接顺序(从左到右)为
(2)装置C中碱石灰的作用是 ,实验开始时和实验结束时都要通人过量的空气其作用分别是
(3)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为 。
24.聚丙烯酰胺主要用于水的净化处理、纸浆的
加工等。丙烯酰胺是一种不饱和酰胺,是生产聚丙烯酰胺的原料。其结构简式为: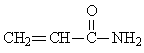 丙烯酰胺可由化合物A(分子式C3H6)经几步反应制得,反应过程如下:
丙烯酰胺可由化合物A(分子式C3H6)经几步反应制得,反应过程如下:
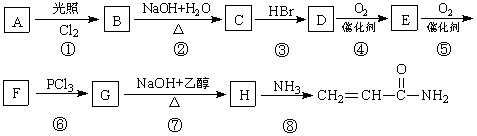
已知:(1)B中没有甲基
(2)3RCOOH+PCl3 3RCOCl+H3PO3
3RCOCl+H3PO3
(3) RCOCl+NH3 RCONH2+HCl 试回答下列问题:
RCONH2+HCl 试回答下列问题:
(1)关于丙烯酰胺的下列叙述中正确的是:
A.能使酸性KMnO4溶液褪色; B.能发生加聚反应生成高分子化合物;
C.与α-氨基乙酸互为同系物; D.能与H2发生加成反应
(2)写出D E的反应方程式:
E的反应方程式:
(3)C D的目的是
;上述反应过程中属于取代反应的是:
。
D的目的是
;上述反应过程中属于取代反应的是:
。
(4)丙烯酰胺有多种同分异构体,同时符合下列要求的同分异构体有多种,试写出2种:①链状,无碳碳叁键;
②同一个碳原子上不能同时连有-NH2和-OH或双键和-NH2(-OH);
③同一个碳原子上不能连有2个双键。
、
23. 已知C为淡黄色固体单质,B、D、E、F标况下均为气体,且水溶液均呈酸性,其中F为黄绿色气体,G为金属,G在CO2中燃烧生成白色和黑色两种固体,K是正盐,A的分子结构和H2O2相似,且均满足8电子结构,以上物质均由短周期元素组成。请完成以下各问题:
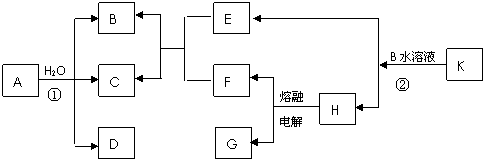
(1)请写出A的化学式 , A的结构式
(2)B、D、E、F气体的水溶液中具有漂白能力的是 、 (写化学式)。
(3)写出G在CO2中燃烧的化学方程式 ;
D和F反应离子方程式 。
22. A、B、C、D、E五种元素原子序数逐渐增大,且均不超过18。其中A与C、B与E分别为同族元素。原子半径A<B<E<D<C,B原子最外层电子数是次外层的3倍,C、D的核外电子数之和与B、E核外电子数之和相等。回答下列问题:
(1)A B (用元素符号表示)
(2)D的最高价氧化物对应水化物的化学式为 。
(3)C与E组成的常见化合物的电子式为 。
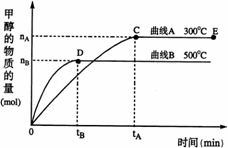
21.一定条件下,在体积为3 L的密闭容器中, 一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)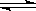 CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= , 升高温度,K值 (填“增大”、“减小”或“不变”);
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)= ;
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是 (填字母序号)。
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
20.某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验
①将镁粉投入冷水中,未见任何现象;
②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;
③将镁粉放入液溴中,未观察到任何明显现象;
④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。
则下列关于镁与溴水的反应机理的论述中正确的是 ( )
A.镁粉只直接与溴水中的溴反应 B.镁粉只与溴水中的酸反应
 C.产生极少量的气泡是由于镁粉与水反应得到 D.镁粉在水的催化下与溴发生反应
C.产生极少量的气泡是由于镁粉与水反应得到 D.镁粉在水的催化下与溴发生反应
19.将0.1 L含有0.02mol CuSO4和0.01molNaCl的水溶液用惰性电极电解。电解一段时间后,一个电极上得到0.01 mol Cu,另一电极析出的气体 ( )
A.只有Cl2 B.只有O2 C.既有Cl2又有O2 D.只有H2
18.某离子晶体的晶体结构中最小重复单元如图所示:A为阴
离子,在正方体内,B为阳离子,分别在顶点和面心,则
该晶体的化学式为 ( )
A.B2A B.BA2 C.B7A4 D.B4A7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com