
24. (1)+2Sn,Fe2(SO4)3(各1分) 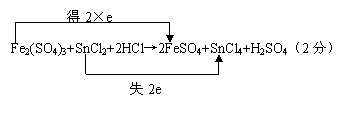 (2)SnCl2→SnCl4(各1分)
(2)SnCl2→SnCl4(各1分)
(3)
(4)2:1(2分)
24.(十四校二)某一反应体系中有反应物和生成物共6种:HCl、H2SO4、SnCl2、SnCl4、FeSO4、Fe2(SO4)3,在反应后的溶液中滴加KSCN溶液不显红色。
(1)该反应中,被氧化的元素是 ,氧化剂是 。
(2)在该反应中,发生氧化反应的过程是 → 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目:
。
(4)FeSO4可用于制墨水、颜料、补血剂等,它易被氧化。FeSO4遇H2SO4(浓)、HNO3时反应的产物是N2O3、H2O、Fe2(SO4)3,则该反应中还原 剂与氧化剂的物质的量之比为 。
24.(浦东一已知:①MnO4― +e → MnO42― (强碱性条件)
②MnO4― + 2H2O + 3e → MnO2 + 4OH― (中性条件)
③MnO4― + 8H+ + 5e → Mn2+ + 4H2O (强酸性条件)
(1)①、③发生的是 (填编号)。
a.氧化反应 b.还原反应 c.氧化还原反应 d.非氧化还原反应
(2)反应:2KMnO4 + K2SO3+ A → 2K2MnO4+ K2SO4 + H2O中,A物质的化学式是 。
(3)配平下列方程式:
KMnO4 + K2SO3 + H2O → MnO2 + K2SO4 + KOH
按上述反应,氧化a mol K2SO3,需 mol KMnO4。
(4)KMnO4与K2SO3反应的方程式系数有多种组合,其原因是
。
24.(十四校一)焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4C1、FeC13、N2、Fe2O3、Fe和X。
(1)根据题意,可判断出X是 (写化学式)。
(2)写出并配平该反应的化学方程式,并标出电子转移的方向和数目:
+ + → + +
(3)发生氧化反应的物质是 ,反应中4mol的氧化剂能 (填“失去”或“得到”) mol电子.
(4)反应中被氧化产生了11.2L(标准状况)的气体时,被还原的物质的质量为 。
 24.(1)H2O
24.(1)H2O
(2)6NH4 + C1+ 4Fe2O3→6Fe+2FeC13+3N2↑+12H2O
(3)NH4C1 得到 24(4)80g
24、 ⑴、NaNO2
(1分)(2)HI→I2(1分)(3)2 Na NO2
+4HI→2NO↑+2H2O+2NaI+I2 (2分)
⑴、NaNO2
(1分)(2)HI→I2(1分)(3)2 Na NO2
+4HI→2NO↑+2H2O+2NaI+I2 (2分)
(4 )0.5 (2分) (5)CD (2分)
24、(八校)在肉制品加工中,使用护色剂--亚硝酸钠必须严格控制用量,确保食用安全。某一反应体系有反应物和生成物共有六种物质:NaNO2 、H2O、 NO、I2 、NaI、HI。已知该反应中 NaNO2 只发生了如下过程:NaNO2 →NO。
(1)该反应中的氧化剂是 (填化学式)。
(2)该反应中,发生氧化反应的过程是 → 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目:
。
(4)若有1mol电子转移,则氧化产物的物质的量是 mol 。
(5)若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于上述中毒、解毒过程的说法中,正确的是( )
A、亚硝酸钠是还原剂 B、维生素C是氧化剂
|
24.(8分)(1)2HI + Na3AsO4 →Na3AsO3 +I2+H2O(配平2分,电子转移方向数目各1分)
(2) Na3AsO3→Na3AsO4 1:1(2分 每空1分)
24.(嘉定一)某一反应体系存在以下五种物质:Na3AsO3、H2O、I2、Na3AsO4、HI。
(1)若H2O是产物,试用这五种物质组成一个合理的反应方程式,配平并标出电子转移的方向和数目:____________________________________________________________。
(2)当pH为5-9时,该反应的体系中氧化反应为由HI→I2;当pH﹤4时,反应反方向进行,此时体系中的氧化反应为___________→ _____________。如果两种情况下反应中的电子转移数相等,则两个反应中的氧化剂的物质的量之比是________________。
(3)物质的氧化性和还原性不仅与溶液的酸碱性有关,还与物质的浓度和反应温度等因素有关。下列各组物质由于浓度不同而发生不同氧化还原反应的是_______(填序号)
①Cu与HNO3溶液②Cu与FeCl3溶液③Fe与HCl溶液④Fe与H2SO4溶液
24.(静安一)已知在稀硫酸中,KBrO3和KI能发生以下反应(均未配平):
BrO3-+H++I-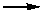 IO3-+Br2+H2O IO3-+H++
Br-
IO3-+Br2+H2O IO3-+H++
Br-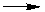 Br2+I2+H2O
Br2+I2+H2O
(1)试比较在酸性条件下BrO3-、Br2、IO3-、I2氧化性的强弱:______>______>______>______。
(2)配平下列反应的离子方程式:
_____BrO3-+_____H++_____I- _____I2+
_____Br-+_____H20
_____I2+
_____Br-+_____H20
反应中的氧化剂是_____________;被氧化的元素是_______。
(3)在稀硫酸中,若KI和KBrO3按物质的量之比6:1.1反应,生成的产物是H2O、______、______、______ (用化学式或离子符号表示)。
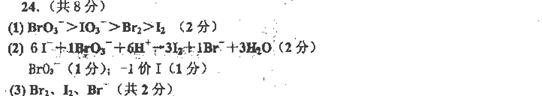
24.(青浦一)虽然氟元素早在1810年就被发现,但170多年来化学家试图用化学方法制取氟单质的尝试一直未获成功。直到1986年,化学家Karl Christe首次用化学方法制得了F2。他提出的三步反应如下(反应①、②里氟元素化合价不变):
① KMnO4 + KF + H2O2 + HF → K2Mn F6 + ____________ + H2O
② SbCl5 + HF → SbF5 + ____________
③ 2K2MnF6 + 4SbF5 → 4KSbF6 + 2MnF3 + F2↑
请根据以上反应回答问题:
⑴.反应①中空格上应填物质的化学式为______________,为什么填这一物质,试用氧化还原反应理论解释___________________________________________________________。
⑵.完成反应②:______________________________________________________。
⑶.反应③中的氧化剂为__________________,被氧化的元素为_________________。
⑷.配平反应①,并标出电子转移的方向和数目。(将答案写在下面空格上)
。
24⑴.O2(1分),KMnO4中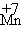 化合价降低,则H2O2必作还原剂 1’
化合价降低,则H2O2必作还原剂 1’
⑵.SbCl5 + 5HF → SbF5 + 5HCl ⑶.K2MnF6(1分),负一价的F 1’
⑷.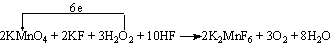
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com