
24.(1)12HCl + 3SnCl2 + 2H3AsO3 → 3H2SnCl6 + 2As + 6H2O(2分)
(2)H3AsO3(1分) +2价的Sn(1分) (3)2 (2分) (4)ad(2分)
24.(松江二)某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知:HCl是反应物之一。
(1)写出并配平该反应的化学方程式:
(2)在该反应中,得电子的物质是 ,被氧化的元素是 。
(3)在反应中,每转移1 mol电子,消耗HCl mol。
(4)下列叙述正确的是 (填写序号)。
a.在相同条件下,第VIIA族元素的阴离子的还原性从上到下逐渐增强
b.得电子越多的氧化剂,其氧化性越强
c.阳离子只能作氧化剂
d.在相同条件下,氧化性顺序:Fe3+>Cu2+>H+>Fe2+
24、(1)a、c (2分) (2)c(Na+)>c(N3¯)>c(OH¯)>c(H+) (2分)
(3)5 N3- + 7 MnO4- + 26 H+ → 7 Mn2+ + 13 _H2O + 15 NO(2分)
(4)3NaN3 → Na3N +4N2↑ (2分)
24.(南汇二)叠氮酸钠(NaN3)是抗禽流感药物“达菲”合成过程中的中间活性物质。
(1)NaN3中存在的化学键有____________。
a、离子键 b、极性共价键 c、非极性共价键
(2)叠氮酸(HN3)与醋酸酸性相似,则NaN3水溶液中离子浓度大小顺序为:
___________________________________________________。
(3)配平下列反应的离子方程式
N3- + MnO4- + H+ → Mn2+ + ______ + NO
(4)3mol NaN3受撞击会生成4mol 氮气和一种离子化合物A,可用于汽车保护气囊。请写出有关反应的化学方程式 ________________________________________。
23.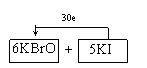 (1)KBrO3+KI+H2SO4→
KIO3+Br2+K2SO4+H2O (2分) (2)Br;KIO3 (各1分)
(1)KBrO3+KI+H2SO4→
KIO3+Br2+K2SO4+H2O (2分) (2)Br;KIO3 (各1分)
(3) (4)KIO3、I2
23.(金山二)某反应体系中的物质有:KIO3、KI、KBrO3、Br2、H2SO4、K2SO4和H2O。
(1)请将KIO3之外的反应物和生成物分别填入以下空格内:

(2)其中被还原的元素是_________;氧化产物是______
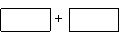 (3)将氧化剂和还原剂及其配平后系数填入下列空格中,并标出电子转移的方向和数目:
(3)将氧化剂和还原剂及其配平后系数填入下列空格中,并标出电子转移的方向和数目:
(4)已知在同样条件下,KIO3能和KI反应生成I2,若在酸性(硫酸)溶液中混合等物质的量的KBrO3和KI,则反应后的氧化产物为_____________
23、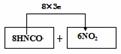 (1)HNCO N2 (同时填写CO2和H2O也正确,化合价1分,化学式正确1分)2分
(1)HNCO N2 (同时填写CO2和H2O也正确,化合价1分,化学式正确1分)2分
(2) (3)1.2 (4)红棕色气体先变浅,后变深 2分
23. (普陀二)三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的氮氧化物(以NO2计),其原理可表示为:当加热至一定温度时,C3N3(OH)3发生分解生成异氰酸:C3N3(OH)3→3HNCO(已知异氰酸中碳元素呈+4价),产生的HNCO能和NO2反应生成N2、CO2和H2O。
(1)在消除NO2的反应中,发生氧化反应的过程是 → (请标明有关元素的化合价变化)。
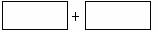
(2)将氧化剂与还原剂及配平好的系数填入下列空格中,并标出电子转移的方向和数目:
(3)按上述反应式进行反应,计算吸收1.0kgNO2气体,消耗三聚氰酸的质量为 kg。
(4)常温下,用注射器吸入20mL NO2气体,用橡皮塞将针孔封闭,把注射器的活塞迅速向外拉至50mL处停止,观察到的现象是: 。
-3 0
24.(1) 2 Fe(OH)3 + 3 NaClO+ 4 NaOH → 2 Na2FeO4 + 3 NaCl + 5 H2O
(2)过程是: FeSO4 → Na2FeO4 (1分)
(3)湿法制备 < 干法制备。(1分)
(4)原因是 过氧化钠强烈吸水和吸收CO2的能力,且反应,则无法氧化铁盐以制备高铁酸盐 (2分)。(5)效率的 0.21 倍(2分)。
24.(卢湾二) (8分)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂。工业上是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾。制备方法有:① 湿法:次氯酸盐氧化法 ② 干法:高温过氧化物法。
(1)湿法制备的的主要反应方程为:
Fe(OH)3 + NaClO+ → Na2FeO4 + NaCl + H2O
在空格中填写适当物质,并配平反应化学方程式。
(2)干法制备中牵涉到的物质有:FeSO4、Na2FeO4、Na2SO4、Na2O2
发生氧化反应的过程是: →
(3)制备相同质量Na2FeO4时转移的电子数,湿法制备 干法制备(填〝>〞或〝<〞或〝=〞)。
(4)干法制备中一定要在密闭的容器中进行,原因是 。
(5)高铁酸钾和二氧化氯都是高效杀菌消毒剂,但消毒效率(单位质量转移的电子数)是不相同的,则高铁酸钾的效率是二氧化氯的 倍。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com