
15.(南京)某化学兴趣小组用火柴、蜡烛、烧杯三种实验材料探究物质燃烧的条件。
[提出问题]物质燃烧需要什么条件?
[猜想与假设]1.有可燃物 2.温度要达到着火点 3.与氧气(或空气)接触
[设计与实验]
[得出结论]猜想正确,燃烧必须同时满足 个条件,只要破坏 个燃烧的 条件,就能达到灭火的目的。
[反思质疑门氢气在氯气中能燃烧。燃烧是否一定要有氧气参加?
[查阅资料1]镁条能在空气中剧烈燃烧,也能在二氧化碳中剧烈燃烧,发出耀眼的白光、放出大量的热;细铁丝可以在氯气中剧烈燃烧,放出大量的热,产生大量棕黄色的烟;磷能在氯气中剧烈燃烧,放出大量的热,产生大量的白色烟雾。
[表达与交流]根据上述内容和课本中对“燃烧”的描述,你认为
叫做燃烧。
[反思质疑2]根据“细铁丝在氧气中燃烧”的实验现象,细铁丝在氧气中燃烧为什么会“火星四射”?
[查阅资料2]含碳细铁丝燃烧时,其中的炭粒生成的CO2气体在熔融液态物质中形成气泡,熔融液态物质因气泡炸裂引起“火星四射”的现象。
[设计实验]为了验证细铁丝在纯氧中燃烧产生“火星四射”现象的原因,你设计的实验方案是 。

14.(晋江)呼吸面具和潜水艇中可用过氧化钠(Na2O2)作为供氧剂。为了探究其反应原理,兴趣小组同学在老师的指导下,进行了如下探究,请你一起参与。
[查阅资料]过氧化钠在常温下与水、二氧化碳反应分别生成氢氧化钠、碳酸钠和氧气。
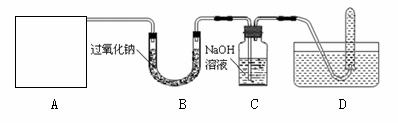 [设计实验]浩明同学想通过下图所示装置探究过氧化钠与二氧化碳的反应,并验证反应产物。
[设计实验]浩明同学想通过下图所示装置探究过氧化钠与二氧化碳的反应,并验证反应产物。
(1)下列是实验室常用的仪器:
①A是二氧化碳气体的发生装置,装配该装置时,应选用的仪器除带导管的双孔橡皮塞外,还需要的仪器有(填名称) 、 。实验室制取二氧化碳的化学方程式 。该装置在实验室还可以用来制取氧气,写出用该装置制取氧气的化学方程式 。
②实验室选择制取气体的发生装置,主要依据是 、 。
(2)用D所示的方法收集氧气,其依据是 ;收集氧气时,还可以选用 法收集。检验D装置试管内收集到中的气体是否氧气的方法、现象及结论是:待D中气体集满后,把试管移出水面,然后
。
(3)C中氢氧化钠的作用是吸收没有参与反应的CO2,如果没有连接这个装置,可能导致的后果是 。
(4)检验B中反应后剩余固体的成分。
|
实验步骤 |
实验现象 |
实验结论及方程式 |
|
①取少量A中反应后的固体于试管中; ② ; ③ 。 |
② ③ |
反应后生成的固体是碳酸钠。写出步骤③的化学方程式
|
[反思与评价](1)通过上述实验,明明同学认为Na2O2与CO2反应除了生成Na2CO3和O2,还有可能生成NaHCO3。你认为他的结论 (选填“正确”或“不正确”),理由是 。写出Na2O2与二氧化碳反应的化学方程式 。
(2)请说说呼吸面具或潜水艇用过氧化钠作为供氧剂的最大的是优点 。
(1)①锥形瓶、长颈漏斗; CaCO3
+ 2HCl =CaCl2 + H2O + CO2↑; 2H2O2 2H2O
+ O2↑
CaCO3
+ 2HCl =CaCl2 + H2O + CO2↑; 2H2O2 2H2O
+ O2↑
②反应物的状态、反应是否需要加热(或反应条件) (2)氧气不易溶于水 向上排空气 用燃着的木条伸入试管中,木条复燃,该气体是氧气 (3)影响氧气的检验(其他合理答案亦可)(4) (步骤、现象各1分,方程式2分,共6分)
|
实验步骤 |
实验现象 |
实验结论 |
|
②滴加稀盐酸 ③将生成的气体通入澄清石灰水中 |
②有气泡产生 ③澄清石灰水变浑浊 |
Ca(OH)2 + CO2 = CaCO3↓ + H2O |
[反思与评价](1)不正确 反应物中没有氢元素,根据质量守恒定律,不可能生成NaHCO3
2Na2O2 + 2CO2 = 2Na2CO3 + O2 (2)吸收呼吸产生的二氧化碳,同时生成氧气
13.(临沂)铜器长期暴露在空气中会生成铜绿(俗称铜锈)。铜锈的主要成分是碱式碳酸铜,碱式碳酸铜不稳定,受热分解成黑色固体物质、无色气体和水。这种黑色固体和无色液体的成分是什么呢?
查阅资料:碱式碳酸铜的化学式是Cu2(OH)2CO3。稀硫酸能与Fe2O3、 CuO等金属氧化物反应,生成盐和水。
提出猜想:某同学根据碱式碳酸铜的化学式对黑色固体、无色液体的成分做出了一下猜想:
①无色气体为二氧化碳;②黑色固体为氧化铜;③…
实验验证:实验装置如图。
在此实验装置中,大试管的管口略向下倾斜的目的是 。
验证①:若猜想①正确,实验过程中应该看到澄清的石灰水 。 产生此现象的化学方程式是 。
在反应完全停止加热时,针对熄灭酒精灯和把导管移出液面这两步操作,你认为应该先进行的操作是 。
验证②:从装置中取下大试管并冷却到室温,然后向大试管中加入足量的稀硫酸,充分振荡,静置后观察实验现象。若猜想②正确,观察到得实验现象应该是 ,发生反应的化学方程式为 。
防止冷凝水回流到试管底部,炸裂试管 变浑浊 Ca(OH)2+CO2===CaCO3↓+H2O 把导管移出液面
黑色固体溶解,溶液变成蓝色CuO+H2SO4==CuSO4+H2O
12.(达州)小亮在做“盐酸中和氢氧化钠溶液”的实验时,滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度。于是他对所得溶液的酸碱性进行探究。
[探究目的]探究所得溶液的酸碱性
[提出猜想]所得溶液可能呈碱性,也可能呈 性,还可能呈 性。
[实验验证]
|
实验操作 |
实验现象 |
结论 |
|
用试管取该溶液1-2mL,滴入1-2滴无色酚酞试液,振荡 |
无色酚酞试液变 |
溶液呈碱性 |
|
无色酚酞试液不变色 |
溶液呈
|
[分析与思考]
⑴若溶液呈碱性,则溶液中使其呈碱性的离子是 (填写微粒符号),为避免碱性溶液污染环境,小亮对所得溶液进行了如下处理:向溶液中逐滴加入 溶液,直到不再产生沉淀为止。然后过滤,把滤液倒入蒸发皿中加热,得到氯化钠晶体,该过程涉及的化学方程式为 。
⑵若无色酚酞试液不变色,为了进一步确定溶液的酸碱性,小亮提出了以下方案:
方案一:取样,加入碳酸钠溶液,若观察到 ,则所取溶液呈酸性;若无明显现象,则呈中性。
方案二:取样,加入金属锌,若有所泡产生,则所取溶液呈酸性,该反应的化学方程式为 ;若无明显现象,则呈中性。
[提出猜想]所得溶液可能呈碱性,也可能呈 酸 性,还可能呈 中 性。
[实验验证]
|
|
实验现象 |
结论 |
|
|
无色酚酞试液变 红 |
|
|
|
溶液呈 酸性或中性 |
[分析与思考]
⑴OH-;氯化铁/氯化铜(化学式也可),FeCl3+3NaOH = Fe(OH)3↓+3NaCl CuCl2 +2NaOH = Cu(OH)2↓+2NaCl ⑵有所泡产生;Zn+ 2HCl = ZnCl2+ H2↑
11.(宿迁)在化学课上,甲同学将燃烧的钠迅速伸入到盛有CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
[提出问题]黑色颗粒和白色物质是什么?
[进行猜想]甲认为黑色颗粒是 ,白色物质可能是Na2O或 或 ,乙同学还认为白色物质是氢氧化钠。
甲同学立刻认为乙同学的猜想是错误的,其理由是
[查阅资料]氧化钠为白色粉末,溶于水生成氢氧化钠: Na2O+H2O == 2NaOH
[实验探究]甲同学对白色物质进行实验探究。
|
实验方案 |
实验操作 |
实验现象 |
结论 |
|
方案1 |
取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 |
溶液变成红色 |
白色物质 为Na2O |
|
方案2 |
①取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 |
出现白色沉淀 |
白色物质 是 。 |
|
②静置片刻,取上层清液于试管中,滴加无色酚酞试液 |
无明显现象 |
[反思评价]丙同学认为方案1得到的结论不正确,其理由是
[得出结论]钠在二氧化碳中燃烧的化学方程式为
炭(C), Na2CO3或Na2O、Na2CO3 反应物中无氢元素(或违背质量守恒定律,答案合理即
可),Na2CO3 ,Na2CO3溶液显碱性也会使酚酞变红, 4Na+3CO2==2Na2CO3+C
10. (乐山)右图是“△△牌发酵粉”的部分信息,课外化学兴趣小组的同学对其进行了如下探究(请你完成相应填空):
(乐山)右图是“△△牌发酵粉”的部分信息,课外化学兴趣小组的同学对其进行了如下探究(请你完成相应填空):
[查阅资料](1)酒石酸是一种易溶解于水的固体有机酸;
(2)发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致;
(3)Na2CO 3受热不分解。
[提出问题]NaHCO3在发酵粉加水或加热时如何产生CO2?
[猜 想]甲.……
乙.酒石酸与NaHCO3在溶液中反应产生CO2
丙.NaHCO3加热产生CO2
 [实验探究]
[实验探究]
(1)小明同学取少量NaHCO3粉末于试管中,加入适量水,无气体产生,从而否定了猜想甲,则猜想甲是 。小明又将酒石酸溶液和NaHCO3溶液混合,产生了CO2,从而验证了猜想乙,说明了NaHCO3具有的性质之一是 ;
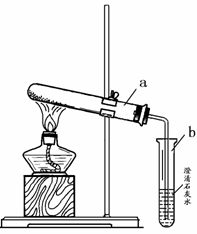
(2)小英同学为探究猜想丙设计了右图所示的实验装置:
小英另取适量NaHCO3粉末加入a试管中,加热,观察到a试管口有水生成,b试管中澄清石灰水变浑浊。b试管中反应的化学方程式为 。
持续加热直至两支试管均不再发生变化时,发现a试管中仍残留有较多白色固体粉末,向该粉末中滴加稀盐酸,有CO2产生,说明该粉末是 。
[小 结]
NaHCO3在发酵粉中产生CO2的条件是 ;
NaHCO3受热发生变化的化学方程式为 ;
NaHCO3 遇水产生二氧化碳,与某些酸反应产生CO2;Ca(OH)2+CO2=CaCO3↓+H2O;Na2CO3 ;加水或加热 ,2NaHCO3 △ =Na2CO3+CO2↑+H2O。
9.(泰州)钢铁、铝合金、铜制品等是应用广泛的金属材料。据估计,每年全世界被腐蚀损耗的钢铁材料,约占全年钢产量的十分之一。某校化学兴趣小组的同学探究金属腐蚀的原因,设计如下实验:
(1)如图,取一根约10cm的光亮铁钉放在自来水中,观察A、B、C三处的变化。几天后,他们会发现 ▲ 处最先出现铁锈,大家结合书本知识知道,铁在空气中生锈实际是铁和 ▲ 、 ▲ 等物质相互作用发生一系列复杂的化学反应的过程。
(2)一同学联想到家里铜制餐具上有一层绿色物质,认为铜在空气中也会生锈。他们上网查阅资料,知道这种绿色物质的化学成分为Cu2(OH)2CO3(铜绿)。他们从铜绿组成和空气的成分大胆猜测,铜生锈除了与铁生锈条件相同外,还应该有CO2参加反应。
请写出铜在空气中生成铜绿的化学方程式 ▲ 。
(3)[查阅资料]孔雀石的主要成分是Cu2(OH)2CO3,也可以表示成CuCO3·Cu(OH)2。与孔雀石相似,还有许多矿物可用xCuCO3·yCu(OH)2(x、y都是正整数)表示,石青就是其中的一种。
[实验探究]为了验证石青的组成成分,他们设计了如下实验,请你共同参与探究。
|
|
实验操作 |
实验现象 |
结论 |
|
步骤l |
取少量石青样品置于大试管中加入足量稀硫酸 |
(1)产生大量气体 (2)溶液呈蓝色 |
(1)石青中含有 ▲
离子 (2)石青中含有 ▲ 离子 |
|
步骤2 |
取少量石青样品置于大试管中加热 |
(1)残留固体呈 ▲
色 (2)大试管内壁 ▲ |
石青加热易分解 |
[反思与拓展]
①确定步骤1中产生气体成分的实验方法是 ▲ 。
②根据以上探究,只要测定出参加反应的石青的质量、生成的氧化铜的质量和 ▲ 的质量,就可确定石青的化学式(即确定x、y的值)。
③防止金属锈蚀的方法很多,如制成不锈钢、在金属表面 ▲ (任写一种方法)。
(1) B O2或氧气 H2O或水 (2) 2Cu+O2+H2O+CO2 ===Cu2(OH)2CO3
(3) [查阅资料]CO32- Cu2+ 黑 有水珠 [反思与拓展]①将产生的气体通入足量的澄清石灰水中 ②水或二氧化碳 ③涂油、漆等
8.(潍坊)(13分)某化学探究小组用HCl与大理石反应研究影响反应剧烈程度的因素。实验温度为25℃、35℃;大理石有细颗粒与粗颗粒两种规格,每次实验取用含碳酸钙60%的大理石10 g;所用HCl的质量分数为9.125%、18.25%,每次实验HCl的用量为20mL(假设9.125%、18.25%的盐酸的密度均为1 g/em3;大理石中杂质不与盐酸反应)。
(1)反应原理:实验中的化学方程式 。
(2)提出假设:HCl与大理石反应的剧烈程度与所用HCl的质量分数、大理石规格、反应温度有关。
(3)实验设计与实施:完成以下实验设计方案并实验。
|
实验 编号 |
T/℃ |
大理石 规格 |
HCl的 质量分数 |
完全反应 的时间/s |
实验目的 |
|
① |
25 |
粗颗粒 |
18.25% |
160 |
(I)实验①和②探究同体积下HCl质量分数对该反应剧烈程度的影响。 (II)实验①和③探究温度对该反应剧烈程度的影响。 (Ⅲ)实验①和④探究大理石规格对该反应剧烈程度的影响。 |
|
② |
|
|
|
210 |
|
|
③ |
35 |
粗颗粒 |
18.25% |
60 |
|
|
④ |
|
|
|
100 |
(4)实验结论: 。
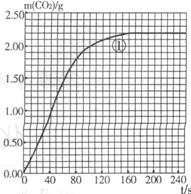 (5)绘制图像:实验①中CO2质量随时问变化的关系如右图,借助简单计算请在右图中画出实验②和③中CO2质量随时间变化关系的曲线(忽略溶液体积变化)。
(5)绘制图像:实验①中CO2质量随时问变化的关系如右图,借助简单计算请在右图中画出实验②和③中CO2质量随时间变化关系的曲线(忽略溶液体积变化)。
说明:可以用铅笔画曲线。
7.(黔东南)维生素C是生命活动中不可缺少的营养物质,不同的饮料中维生素C的含量不同。下面是小明同学运用学到的实验方法测定橙汁、果味饮料中维生素C的含量。 .
.
[实验目的]测定不同饮料中维生素C的含量。 .
.
[实验原理] .(1)维生素C是一种无色易溶于水的有机物,能与碘水反应,使碘水褪色;
.(1)维生素C是一种无色易溶于水的有机物,能与碘水反应,使碘水褪色; .
.
(2)淀粉遇到碘水变
色。 .
.
[实验试剂]碘水、淀粉溶液、已知浓度的标准维生素C溶液、蒸馏水 .
.
[实验过程] 步骤1:在4支试管中分别盛有3.0 mL的下列物质:①蒸馏水,②标准维生素C溶液,
步骤1:在4支试管中分别盛有3.0 mL的下列物质:①蒸馏水,②标准维生素C溶液, .③橙汁,④果味饮料。分别向4支试管中滴加2滴淀粉溶液。
.③橙汁,④果味饮料。分别向4支试管中滴加2滴淀粉溶液。 .
.
步骤2:用4支相同的胶头滴管分别向①-④支试管中逐滴滴加碘水至刚好变色,并记录滴数。 .
.
[实验记录] .
.
|
测定物质 |
① |
② |
③ |
④ |
|
滴入碘水的数量(滴) |
1 |
8 |
15 |
5 |
试回答下列问题: .
.
(1)你认为小明测定的两种饮料中, 的维生素C的含量较高; .
.
(2)有的同学认为测定物质标准维生素C溶液是多余的,你认为呢?请说明理由:  . ;
. ; .
.
(3)化学实验需要控制变量。下列 (填序号)情况会影响到测定结果。 .
.
A.每次实验所用饮料的颜色不同 B.量取的被测试物质的体积不同 .
.
C.试管的大小不同 D.没有用同一规格的胶头滴管滴加碘水 .
.
[回顾与反思]实验中所用的淀粉溶液的作用是
。 .
.
[实验原理](2)蓝 [实验记录](1)橙汁(或③) (2)不是多余的,因为测定标准维生素C溶液是确定维生素C含量的标准,以便估算出饮料中维生素C的浓度(其他合理答案也可)
(3)A B D [回顾与反思]确定维生素C是否与碘水完全反应
6.(徐州)某化学课外兴趣小组通过查阅资料知道过氧化钠(Na2O2)能与水反应生成氢氧化钠和氧气,于是他们做了以下探究实验。
实验1:向包有过氧化钠粉末的脱脂棉上滴水,脱脂棉燃烧起来。
请你对脱脂棉燃烧的原因进行分析_______。
实验2:向盛有过氧化钠粉末的试管中加入水,充分反应后,取试管中的少量溶液放入另一小试管中加入几滴无色酚酞试液,溶液变红,过了一会,红色又褪去了。
[提出问题]溶液为什么先变红,过了一会,红色又褪去了呢?
[猜想]甲同学认为是氢氧化钠溶液与空气中的二氧化碳反应的缘故。乙同学认为甲同学的猜想不正确,理由是_____________________。
[查阅资料]①滴加酚酞呈现红色的溶液遇到H2O2时,H2O2可以破坏酚酞的结构,使酚酞在碱性溶液中不能再显红色;②酚酞在稀碱性溶液中稳定显红色,而在浓氢氧化钠等溶液中显红色后又褪色。
[猜想]通过查阅资料后,该兴趣小组对溶液的红色褪去的主要原凶义进行了猜想。
猜想A:过氧化钠与水反应可能生成了H2O2;猜想B:生成的氢氧化钠溶液可能太浓。
[实验探究]请你将下列实验方案填写完整。
|
猜想 |
实验操作 |
实验现象 |
结论 |
|
A |
取过氧化钠与水反应后的溶液放入试管中,_____ ___________________________________________ |
_________________ |
猜想A 正确 |
|
B |
取过氧化钠与水反应后的溶液放入试管中, ________________________________________ |
________________ |
猜想B 错误 |
[得出结论]根据实验分析,过氧化钠与水反应除了生成氢氧化钠和氧气外,还存在另一反应,则另一反应的化学方程式为____________________________________。
实验l:反应中产生氧气和放出热量,使脱脂棉达到燃烧的条件
实验2:猜想:氢氧化钠溶液与二氧化碳反应后生成的碳酸钠溶液也显碱性,也能使酚酞试液变为红色
|
实验操作 |
实验现象 |
结论 |
|
加入适量的二氧化锰后,将带火星的术条放在试管口 |
产生气泡,木条复燃 |
猜想A正确 |
|
先加入适量的水,然后再滴加酚酞试液 |
溶液变红,一会红色又消失 |
猜想B错误 |
[得出结论]Na2O2+2H2O=2NaOH+H2O2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com