
25.(雅安)金属钠很软,可以用刀切割。切开外皮后,可以看到钠具有银白色的金属光泽。钠是热和电的良导体。钠的密度是0.97g/cm3,比水的密度小,钠的熔点是97.81℃,沸点是882.9℃。将金属钠放入水中,可以反应生成NaOH和H2 ;钠跟氧气混合加热生成淡黄色的过氧化钠(Na2O2)固体,钠跟CO2在加热条件下反应生成碳酸钠和单质碳。
(1)试写出钠跟水反应的化学方程式
(2)小刘同学用图A装置做钠跟氧气反应实验,观察到生成物中出现黑色固体,则该黑色固体是 (填化学式),试写出相应的化学反应方程式
_________________________________。
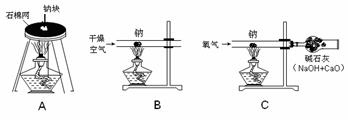
(3)为了探究黑色固体成分,小刘同学进行了下列探究。
探究反应中CO2的来源:
猜想①:CO2的来源于 ;猜想②:CO2的来源于 ;
在上述两种来源中, (填序号)是CO2的主要来源。用图B和C装置实验的目的是 。
(1)2Na+2H2O = 2NaOH+H2↑
(2)C ;4Na+3CO2 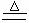 2Na2CO3
+ C
2Na2CO3
+ C
(3)①空气 ②酒精燃烧或①酒精燃烧,②空气;②或①(注意前后对应);验证空气中CO2 是否参加反应或验证猜想。
24.(青岛)某化学实验室有一瓶失去标签的碱溶液,可能是氢氧化钠或氢氧化钙溶液;小王同学认为是氢氧化钙溶液。请你按小王同学的猜想,进行下列实验探究,并按要求填写写表:
|
猜想 |
实验步骤 |
实验现象 |
结论与相应的化学方程式 (若不反应可不写化学方程式) |
|
可能 是氢 氧化 钙溶 液 |
方案Ⅰ:用试管取约2mL该溶液,向其中滴加几滴____________溶液 |
_______________ |
该溶液是_______________, 化学方程式: __________________________ |
|
方案Ⅱ:(选用与方案Ⅰ不同类别的其他物质)____________________ ____________________ |
_______________ |
该溶液是_______________, 化学方程式: __________________________ |
方案Ⅰ:无色酚酞试液 试液变红 氢氧化钙溶液 方案Ⅱ:用试管取约2mL该溶液,向其中通入二氧化碳气体 生成白色沉淀 Ca(OH)2 + CO2 == CaCO3↓+ H2O
23.(东营)化学科代表小聪与小明同学帮助实验老师整理化学药品室时,发现分别放在两个试剂瓶中的两片用砂纸磨得光亮的银白色金属,未贴标签。到底它们是哪种金属?两位同学首先对这两种金属X和Y的金属活动性顺序进行实验探究。
(1)进行猜想:
①科代表小聪猜想:活动性X大于Y。
②小明同学猜想:活动性Y大于X。
(2)设计实验方案、进行实验、获得知识。完成如下实验报告,并回答后续有关问题。
|
①实验步骤 |
②实验现象 |
③结论 |
|
__ __ |
金属Y表面无明显变化,金属X的表面有气泡冒出。 将燃着的木条放在装金属X的试管口,气体燃烧 |
__ 科代表小聪的猜想:_______ (“正确”或“不正确”) |
(3)上述实验之前,实验老师只知道X、Y是银铁中的各一种,则根据实验结果说明Y就是_______。实验室急需一定量的Y粉末,科代表小聪认为可用现有的X金属粉末和Y的盐溶液、蒸馏水等药品,配以必要的仪器来制得急需的Y粉末,原因是(用反应的化学方程式表示)_________________。
(4)实验老师经实验分析得知制得的Y粉末中含有未反应完的X粉末,若用化学方法将杂质X粉末除去,两个同学经讨论、交流一致认为可选用的除杂质试剂是_________。
(2)①将金属片X、Y分别放入两支试管中,再分别加入稀硫酸(或稀盐酸)2mL
③在金属活动顺序里,X排在氢前,Y排在氢后(或金属的活动性为X大于Y) 正确
(3)银 Fe + 2 AgNO3 === Fe(NO3)2 + 2Ag (4)盐酸(或稀硫酸)
21.(安徽)小亮发现:收集的氧气占集气瓶容积的60%(空气占40%)时,能使带火星的木条复燃。那么,使带火星的木条复燃的氧气浓度的最低值是多少呢?小亮对此展开探究:
第一组实验:取5只集气瓶,编号为①、②、③、④、⑤,分别装人其总容积10%、20%、30%、40%、50%的水。用排水法收集氧气,恰好把5只集气瓶中的水排去。将带火星的木条依次插入①~⑤号瓶中,记录实验现象。
小亮在前一组实验的基础上又做了第二组和第三组实验,三组实验的数据和现象见下表。
|
|
第一组 |
第二组 |
第三组 |
||||||||
|
集气瓶编号 |
① |
② |
③ |
④ |
⑤ |
① |
② |
③ |
④ |
⑤ |
① |
|
收集的O2占容积的体积分数(%) |
l0 |
20 |
30 |
40 |
50 |
3l |
33 |
35 |
37 |
39 |
34 |
|
带火星木条的状况 |
微亮 |
亮 |
很亮 |
复燃 |
复燃 |
很亮 |
很亮 |
复燃 |
复燃 |
复燃 |
很亮 |
请根据实验回答下列问题:
⑴ 写出一个实验室制取氧气的化学方程式 。
⑵ 使用带火星的木条验满氧气的方法是否可靠: (填“是”或“否’')。
⑶ 集气瓶中氧气的体积分数 = 收集的氧气占容积的体积分数
+ 瓶中空气占容积的体积分数 × %。
⑷ 收集的氧气占容积的体积分数最低为 %时,可使带火星的木条复燃,这时集气瓶中氧气分数是 %(计算结果保留整数)。
注意:若答对⑸、⑹两小题将奖励4分,但化学试卷总分不超过60分。
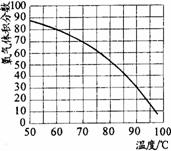 ⑸ 用带火星的木条直接检验双氧水受热分解产生的氧气时,往往难以复燃,这是因为在加热生成氧气的同时产生大量水蒸汽所致,此时混合气体中氧气的体积分数随温度变化的曲线如右下图所示。若只考虑氧气的体积分数对实验结果的影响,欲使带火星的木条复燃,应将加热双氧水的最高温度控制在
℃。
⑸ 用带火星的木条直接检验双氧水受热分解产生的氧气时,往往难以复燃,这是因为在加热生成氧气的同时产生大量水蒸汽所致,此时混合气体中氧气的体积分数随温度变化的曲线如右下图所示。若只考虑氧气的体积分数对实验结果的影响,欲使带火星的木条复燃,应将加热双氧水的最高温度控制在
℃。
⑹ 采取“半值法”探究能减少实验次数。例如:第一组实验若按③、④的编号顺序进行实验,即可确定下一组实验收集的氧气占容积的体积分数应在30%~40%之间,从而省去编号为①、②、⑤的实验。同理,第二组实验可以省去的实验编号为 。
⑴ 2H2O2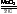 O2↑+2H2O(其他合理答案均给分)
O2↑+2H2O(其他合理答案均给分)
⑵ 否(1分) ⑶ 21(1分) ⑷ 35(1分)
⑸、⑹两小题共奖励4分,化学试卷总分不超过60分。
⑸ 82(81~84之间均给分)(2分)
⑹ ①、④、⑤(2分)
20. (江西)超市中的许多食物用保鲜膜包装后出售。保鲜膜为什么可以“保鲜”呢?
(江西)超市中的许多食物用保鲜膜包装后出售。保鲜膜为什么可以“保鲜”呢?
[设计实验]在A、B、C三只相同的玻璃杯中,分别注入等体积的
蒸馏水,并在各玻璃杯外壁标明刻度,如图所示放置一周。
[实验现象]一周后发现:A杯中的水量几乎不变;而C杯中的水量减少较多;B杯中的现象是 ;
[解释]请用分子的知识解释C杯中水量减少的原因: ;
[结论]保鲜膜除了可以阻止食物中水分流失,还能隔绝 ,防止食物腐败。
[提出新问题]制作保鲜膜的材料是热固性塑料还是热塑性塑料呢?
[实验]在一只试管中放入少量保鲜膜碎片,用酒精灯缓缓加热,观察到碎片熔化,冷却后变成
固体,加热又可以熔化。由此得出:制作保鲜膜的材料是 (填“热塑性”或“热固性”)塑料。
[反思] (1)保鲜膜虽然能延长食品的保鲜期,但大量使用后丢弃会造成 ,所
以要控制使用。
(2) 化学物质可以造福人类,但有时也会给人类带来危害,请你再举一例说明 。
19.(黄冈)(6分)端午阳节后,小丽带着快乐的心情返回学校。当她来到实验室时,意外地发现实验桌上有瓶敞口放置已久的NaOH溶液,由此,激发了她的探究欲望。
[提出问题]这瓶NaOH溶液一定变质了,其变质程度如何呢?
[提出猜想]小丽的猜想:NaOH溶液部分变质。你的新猜想: 。
[实验探究]小丽设计如下实验来验证自己的猜想,请根据表中内容填写小丽实验时的现象
|
实验步骤 |
现象 |
结论 |
|
取少量NaOH溶液样品于试管中,先滴加足量的CaCl2溶液,然后再滴加酚酞试液。 |
|
NaOH溶液部分变质 |
假设你的猜想正确,并按小丽的实验方案进行实验,则你观察到的实验现象___________________。
[实验反思]⑴下列物质①BaCl2溶液、②Ca(NO3)2溶液、③Ca(OH) 2溶液、④Ba(OH)2溶液,不能替代小丽实验中CaCl2溶液的是________(填序号)。
⑵小丽第二次滴加的试剂除用指示剂外,还可以用________________替代。
[拓展应用]保存NaOH溶液的方法是 。
[提出猜想]NaOH溶液全部变质 [实验探究]产生白色沉淀,酚酞试液变红 ;产生白色沉淀,酚酞试液不变色 [实验反思](1)③④ (2)硫酸铜溶液 (或NH4Cl溶液) [拓展应用]密封保存
18.(常州)小黄用右图装置测定铜锌合金中锌的质量分数和锌的相对原子质量。主要实验步骤如下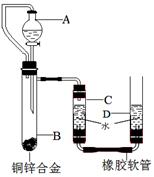 (必要的固定装置已略去):
(必要的固定装置已略去):
①连接装置并检查装置气密性;
②加入药品和水;
③记录C中液面刻度(C为带有刻度的玻璃管);
④由A向B中滴加试剂至过量;
⑤待B中不再有气体产生并恢复至室温后,记录C中液面刻度,计算得到气体的体积为V mL(经查,该气体密度为ρg/L);
⑥将B中剩余固体过滤、洗涤、干燥并称重,称得剩余固体质量为W g。
(1)A仪器的名称为 ▲ ;
(2)B中发生的反应的化学方程式为: ▲ ;
(3)小黄在实验前将块状的铜锌合金磨成粉末状,其目的是: ▲ ;
(4)如何检验该装置的气密性: ▲ ;
(5)为使测得的气体体积更精确,记录C中液面刻度时,除使视线与凹液面的最低处相平外,还应 ▲ ;
(6)小黄发现实验中由于缺少某一步骤导致数据缺乏而无法计算,该步骤是: ▲ ;
(7)通常实验前须估算药品用量,如果实验过程中,发现盐酸的量不足,应中途加酸还是重新实验: ▲ ;理由是 ▲ 。
(1)分液漏斗 (2)Zn+H2SO4==ZnSO4+H2↑ (3)加快反应的速率 (4)提高D管,静止片刻后,C、D液面仍存在高度差,则气密性良好 (5)使D、C中的液面相平 (6)测量铜锌合金样品的质量 (7)重新实验
1.Na2CO3+HCl===NaHCO3+NaCl;Ⅱ.NaHCO3+HCl===NaCl+H2O+CO2↑
试根据以上信息回答下列问题:
(1)醋酸可以使紫色石蕊试液变 ▲ ;
(2)根据信息①可知醋酸应置于阴凉处 ▲ 保存;
(3)试写出醋酸与纯碱第一步反应的化学方程式: ▲ ;
(4)他们向纯碱溶液中滴加醋酸到不再产生气泡后,将所得溶液蒸发结晶,获得了少量白色固体。王刚认为这就是纯净的NaAc,而程明则认为里面含有HAc。你认为 ▲ 的观点正确,理由是: ▲ 。
(1)红 密封 (2)Na2CO3+HAc==NaHCO3+NaAc (3)王刚 由于HAc具有挥发性,在蒸发过程中已经挥发掉
17.(常州)程明和王刚不小心将纯碱洒到白醋(其有效成分为醋酸,可用HAc表示)里,发现有大量气泡产生,这使他们对醋酸产生了新认识:醋酸像盐酸一样,能与纯碱反应;此外,他们通过查阅相关资料,还检索到以下信息:①醋酸与盐酸都具有较强挥发性;②醋酸是一种有机酸,具有酸的通性,且其钠盐(NaAc)受热不易分解;③盐酸与纯碱的反应分以下两步进行:
16.(汕头)为确定木炭还原氧化铜后的固体成份,请你与兴趣小组的同学完成以下探究。
[对固体猜想]
猜想I:全部是金属铜; 猜想Ⅱ:除铜外,还含有氧化铜;
猜想Ⅲ:除铜外,还含有木炭; 猜想Ⅳ:除铜外,还含有氧化铜、 。
[进行实验]实验流程见下图:
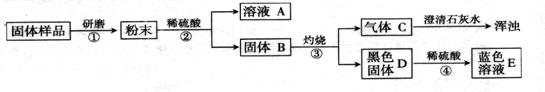
[问题与讨论]
(1)步骤②包括溶解、 两步操作,它们共同用到的玻璃仪器是烧杯、 。
(2)C的化学式为 ,D的化学式为 ,由此推出固体B中含有 (写化学式),步骤④发生反应的化学方程式为 。
(3)结合(2)的结论推断:如果溶液A显蓝色,则溶液A的溶质的化学式为 ,说明样品
中含有 ,则证明猜想 成立;如果溶液A无色,则证明猜想 成立。
猜想IV: 木炭 (1) 过滤 玻璃棒 (2) CO2 CuO C和Cu CuO+ H2SO4===CuSO4+ H2O (3) CuSO4 氧化铜(或CuO) IV Ⅲ
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com