
9.有关原电池的工作原理中的下列说法中不正确的是( )
A.电池负极发生氧化反应
B.电池正极发生还原反应
C.电子流向是从负极流向正极(外电路)
D.电流方向是从负极流向正极(外电路)
8.如图所示,a、b、c、d均为石墨电极,通电进行电解。下列说法正确的是( )
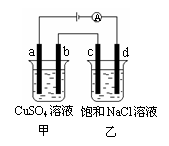 A.乙烧杯中d的电极反应为 2Cl––2e–
=Cl2↑
A.乙烧杯中d的电极反应为 2Cl––2e–
=Cl2↑
B.a、c两极产生气体的物质的量相等
|
2NaCl + 2H2O
 2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑
D.甲、乙两烧杯中溶液的pH均保持不变
7.已知:H+(aq)+OH-(aq)===H2O(l) △H=-57.3 kJ·mol-1。现将一定量的稀盐酸、浓硫酸、稀醋酸分别和1L 1mol·L-1的NaOH溶液恰好完全反应,其反应热分别为△H1、△H2、△H3,,则△H1、△H2和△H3的大小关系为( )
A.△H1==△H2>△H3 B.△H3>△H2>△H1
C.△H3>△H1>△H2 D.△H2>△H1>△H3
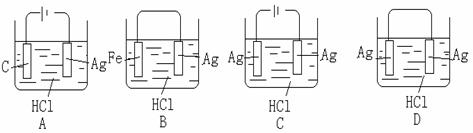
6.某学生欲完成2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为哪种设计是可行的( )
5.用惰性电极实现电解,下列说法正确的是( )
A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
4.下列叙述不正确的是( )
A.锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率
B.白铁(镀锌铁)镀层破损后,先被腐蚀的是铁
C.钢铁表面常易锈蚀生成Fe2O3·nH2O
D.金属的腐蚀主要是电化学腐蚀
3.下列关于铜电极的叙述正确的是( )
A.铜锌原电池中铜是负极
B.用电解法精炼粗铜时粗铜作阴极
C.在镀件上电镀铜时用金属铜作阳极
D.电解稀硫酸制H2、O2时铜作阳极
2.已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A.H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) ΔH=-484kJ·mol-1
C.H2(g)+1/2O2(g)=H2O(g) ΔH=+242kJ·mol-1
D.2H2(g)+O2(g)=2H2O(g) ΔH=+484kJ·mol-1
1.氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为:
H2(g)+1/2O2(g)=H2O(l); △H=-285.8 kJ / mol
CO(g)+1/2O2(g)=CO2(g); △H=-283.0 kJ / mol
C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l); △H=-5518 kJ / mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l); △H=-890.3 kJ / mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少的是( )
A. H2(g) B. CO(g) C. C8H18(l) D. CH4(g)
32.a为16mol,N2的转化率为18.75%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com