
9. 在恒温恒容的密闭容器中,发生反应3A(g)+B(g) xC(g)。
xC(g)。
Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;
Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。
下列说法正确的是( )
A、若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
B、若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
C、若x=3,则Ⅱ体系起始物质的量应当满足3 n(B) =n(A)+3
D、若Ⅱ体系起始物质的量当满足3 n(C) +8n(A)=12 n(B)时,可断定x=4
8. 在一定温度下,向容积固定不变的密闭容器中充入a mol NO2,发生如下反应:2NO2(g) N2O4(g) △H<0。达平衡后再向容器中充入amol NO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
N2O4(g) △H<0。达平衡后再向容器中充入amol NO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
A.相对平均分子质量增大 B.NO2的转化率提高
C.NO2的质量分数增大 D.反应放出的总热量大于原来的2倍
7. 合成氨反应:N2(g)+3H2
合成氨反应:N2(g)+3H2 2NH3(g)
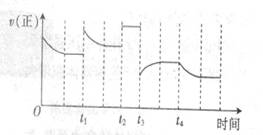
△H=-92.4kJ·mol-1,在反应过程中,正反应速率的变化如下图,下列说法正确的是( )
2NH3(g)
△H=-92.4kJ·mol-1,在反应过程中,正反应速率的变化如下图,下列说法正确的是( )
A.t1时升高了温度 B.t2时使用了催化剂
C.t3时降低了温度 D.t4时减小了压强
6. 下列各组热化学方程式程中,化学反应的△H前者大于后者的是 ①C(s)+O2(g)=CO2(g) △H1 C(s)+1/2O2(g)=CO(g) △H2 ②S(s)+O2(g)=SO2(g) △H3 S(g)+O2(g)=SO2(g) △H4 ③H2(g)+1/2O2(g)=H2O(g) △H5 2H2(g)+O2(g)=2H2O(l) △H6 ④CaCO3(s)=CaO(s)+CO2(g) △H7 CaO(s)+H2O(l)=Ca(OH)2(s) △H8 A、① B、④ C、②③④ D、①②③
5.分析下表中的四个热化学方程式,判断氢气和丙烷的燃烧热分别是( )
|
“嫦娥一号”发射火箭燃料 |
液氢(H2) |
①2H2(g)+O2(g)=2H2O(l)
△H=-571.6kJ·mol-1 ②2H2(l)+O2(l)=2H2O(g) △H=-482.6kJ·mol-1 |
|
北京奥运会“祥云”火炬燃料 |
丙烷(C3H8) |
③C3H8(l)+5O2(g)=3CO2(g)+4H2O(g) △H=-2013.8kJ·mol-1 ④ C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2221.5kJ·mol-1 |
A.571.6 kJ·mol-1,2221.5kJ·mol-1 B.241.3 kJ·mol-1,2013.8 kJ·mol-1
C.285.8 kJ·mol-1,2013.8 kJ·mol-1 D.285.8 kJ·mol-1,2221.5 kJ·mol-1
4.在一定温度下的刚性密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:
A(s)+2B(g) C(g)+D(g) 已达到平衡状态的是( )
C(g)+D(g) 已达到平衡状态的是( )
①混合气体的压强,②混合气体的密度,③B的物质的量浓度,④气体的总物质的量,
⑤混合气体的平均相对分子质量,⑥v(C)与v(D)的比值
A.②③⑤ B.①②③ C.②③④⑥ D.①③④⑤
3. 已知“凡气体分子总数增多的反应一定是熵增大的反应”。根据所学知识判断,下列反应中,在所有温度下都不自发进行的 A.2O3(g) === 3O2(g) △H<0 B.2CO(g) === 2C(s)+O2(g) △H>0 C.N2(g) + 3H2(g) === 2NH3(g) △H<0 D.CaCO3(s) === CaO(s) + CO2(g) △H>0
2. 已知H2 (g)、C2H4(g)和C2H5OH(1)的燃烧热分别是285.8kJ·mol-1、1411.0kJ·mol-1和1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为 A.-44.2kJ·mol-1 B.+44.2kJ·mol-1 C.-330kJ·mol-1 D.+330kJ·mol-1
1. 下列有关反应热的说法中正确的是 A.一个化学反应是否能在常温下发生与该反反应的△H值的大小没有必然联系 B.中和热△H=-57.3kJ·mol-1,所以,1.00L 1.00mol·L-1H2SO4与稀的NaOH溶液恰好完全反应放出57.3kJ的热量 C.用等体积的0.50mol·L-1盐酸、0.55mol·L-1NaOH溶液进行中和热测定的实验,会使测得的值偏大 D.在101KPa时,1molCH4完全燃烧生成CO2和水蒸气放出的热量就是CH4的燃烧热
1.在20℃时食盐的溶解度为36g,取一定量该温度下的饱和溶液用惰性电极进行电解,当阳极析出11.2L气体(标准状况)时,食盐完全电解,所得溶液密度为1.20g·mL-1;试计算:
(1)电解时,所取饱和食盐水的质量?
(2)电解后溶液中NaOH的物质的量浓度为多少?
(3)要使溶液恢复到原状态,需加入何种物质,其质量是多少克?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com