
24、(10分)某烧碱样品含有少量不与酸作用的杂质,为了滴定其纯度,进行以下滴定操作:
A、配制250ml烧碱溶液;
B、用碱式滴定管取25.00ml烧碱溶液于锥形瓶中并滴加几滴酚酞做指示剂;
C、在天平上准确称取烧碱样品wg,在烧杯中用蒸馏水溶解;
D、将物质的量浓度为c的标准硫酸溶液装入酸式滴定管调整液面记下开始读书为V1ml;
E、在锥形瓶下垫一张白纸,滴至红色刚好消失且半分总内不再变化为止,记下读数V2ml。
就此实验完成下列填空:



 ⑴正确的操作顺序是:(用编号字母填写) D 。
⑴正确的操作顺序是:(用编号字母填写) D 。
⑵观察滴定管里液面的高度时应注意: 。
⑶D操作中液面应调节到 ,尖嘴部分应 。
⑷某学生实验时把锥形瓶用烧碱样品洗涤,使测定的浓度偏高还是偏低? 原因是
。
⑸该烧碱样品纯度的计算式为 。
23、(4分)实验室保存下列试剂,采取下列措施不正确的是
A、FeSO4溶液中放入一枚铁钉
B、FeCl3溶液中加入少量盐酸
C、用带磨口玻璃塞的试剂瓶盛NaSiO3溶液
D、NaBr溶液中加入少量溴水
22、(6分)现有25℃时0.1mol/L的氨水。请回答以下问题:
⑴若向氨水中加入少量硫酸铵固体,此时溶液中C(OH‑)/C(NH3.H2O) (填“增大”、“减小”或“不变”)
⑵ 若向氨水中加入稀硫酸,使其恰好中和,所得溶液的PH 7(填“<”“>”或“=”),用离子方程式表示其原因 。
⑶若向氨水中加入PH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子物质的量浓度由大到小的关系是 。
21、(4分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g) + H2(g) ≒CO(g) + H2O(g),其化学平衡常数K和温度t的关系如下表所示:
|
t/℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
⑴该反应的化学平衡常数表达式为K=
⑵该反应为 反应(填“吸热”或“放热”)
⑶能判断该反应达到化学平衡状态的依据是( )
A、 容器中压强不变
B、  混合气体中C(CO)不变
混合气体中C(CO)不变
C、 V(H2)正=V(H2O)逆
D、C(CO2)=C(CO)
⑷某温度下,平衡浓度符合下式:C(CO2). C(H2)=C(CO).C(H2O),此时的温度为 ℃
20、(4分)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,该反应的热化学方程式为:
。若1g水蒸气转化成液态水放热2.444kJ,则氢气的燃烧热为
KJ/mol
19、(10分)元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表是元素周期表的一部分,请依据该表回答问题。
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
|
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
|
2 |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
⑴可用作半导体材料的是 元素(填元素符号),它在元素周期表中的位置为第 周期 (族)。
⑵画出第三周期ⅠA族元素的原子结构示意图 ,该元素与同周期ⅧA族元素组成的化合物的电子式是 。以该化合物为主要原料在生产中可支取多种重要的化工产品,请举一例(用化学方程式来说明) 。
 ⑶在第二周期元素的最高价氧化物对应的水化物中,酸性最强的是 (填化学式,下同);具有两性的是
,其与氢氧化物溶液反应的化学方程式为
。
⑶在第二周期元素的最高价氧化物对应的水化物中,酸性最强的是 (填化学式,下同);具有两性的是
,其与氢氧化物溶液反应的化学方程式为
。
18.2.0molPCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应PCl3(g) + Cl2(g) ≒ PCl5(g)达平衡时,PCl5为0.4mol。如果此时一走1.0mol PCl3和0.50molCl2,在相同温度下再达到平衡时PCl5的物质的量是
A.0.40mol B.0.20mol
C.大于0.20mol,小于0.40mol D.小于0.20mol
第Ⅱ卷(非选择题 共46分)
17.下列离子方程式书写正确的是
A.钢铁发生电化腐蚀的负极反应:Fe – 3e- = Fe3+
B.电解硫酸铜溶液时的阴极反应:4OH- - 4e- = 2H2O + O2
C.碳酸氢钠溶于水溶液呈碱性:HCO3- + H2O ≒ H3O+ + CO32-
D.碳酸氢钠饱和溶液与硫酸铝溶液混合:Al3++3HCO3-=Al(OH)3 +3CO2
16.右图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述不正确的是
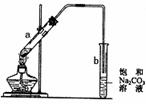 A.向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,
A.向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,
再加入冰醋酸
B.试管b中导气管下端管口不能浸入液面的原因是防止实验过
程中产生倒吸现象
C.实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平
衡向生成乙酸乙酯的方向移动
D.试管b中饱和Na2CO3溶液的作用之一是吸收随乙酸乙酯蒸出的少量乙酸和乙醇
15.有①Na2CO3溶液②CH3COONa溶液③NaOH溶液个25ml,下列说法正确的是
A.物质的量浓度均为0.1mol/L,3种溶液PH的大小顺序是③>②>①
B.物质的量浓度均为0.1mol/L,将3种溶液稀释相同倍数,PH变化最大的是②
C.物质的量浓度均为0.1mol/L,分别加入25ml0.1mol/L盐酸后,PH最大的是①
D.PH均为9时,3种溶液的物质的量浓度的大小顺序是③>①>②
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com