
1.已知反应:①Cl2+2KBr=2KCl+Br2, ②KClO3 +6HCl=3Cl2+KCl +3H2O,③2KBrO3 +Cl2=Br2 + 2KClO3,下列说法正确的是( )
A.上述三个反应都有单质生成,所以都是置换反应
B.氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2
C.反应②中还原剂与氧化剂的物质的量之比为6:1
D.③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol
(该题主要考查氧化还原反应的规律、氧化剂和还原剂的判断、对化学计量数的理解以及得失电子守恒的简单应用)
6.电子守恒规律的应用
(1)根据电子得失数相等,进行部分氧化(还原)的相关计算;
(2)根据电子得失数相等,推断氧化还原反应中化合价变化情况,或推断产物;
(3)根据电子得失数相等,求某一反应中被氧化与被还原的原子数之比;
(4)根据电子得失数相等,进行电解产物计算。
典型题点击
5.氧化性、还原性强弱的判断与应用
(1)根据几个化学方程式,排列氧化剂(还原剂)的氧化性(还原性)强弱顺序;
(2)根据溶液中的置换反应、原电池电极反应,判断金属的还原性(或金属性)强弱顺序;
(3)根据物质氧化性、还原性的强弱顺序,判断某一反应能否进行,或选择某一反应的氧化剂(还原剂)
4.氧化还原反应的典型计算:依据氧化剂得电子总数与还原剂失电子总数相等,列出守恒关系式求解。
3.配平氧化还原反应方程式,判断氧化还原反应电子转移的方向和数目。
依据原则:氧化剂化合价降低总数=还原剂化合价升高总数
方法步骤:划好价、列变化、求总数、配系数。
2.氧化还原反应规律,氧化性或还原性强弱比较规律。在同一氧化还原反应中,氧化性强弱顺序:氧化剂 > 氧化产物 ; 还原性强弱顺序:还原剂 > 还原产物
1.氧化和还原、氧化性和还原性、氧化剂和还原剂等概念。元素处于最高价,只有氧化性;处于最低价时,只有还原性;处于中间价态时,既有氧化性又有还原性。概念可简记为“升-失-氧-还;降-得-还-氧”再进行理解。
25. 为了消除人体碘缺乏病,我国政府规定食用盐必须是加碘食盐。所谓碘盐就是在食盐中加入一定量的碘酸钾(KIO3)。计算(精确到0.1):
⑴碘酸钾中碘元素的质量分数 。
⑵若每天食用7g食盐,从中摄取0.15mg碘,则从1kg碘盐中能摄取碘多少mg。
24.一种新型的甜味剂木糖醇(C5H12O5)悄悄地走入我们的生活。
⑴它由 几种元素组成;
⑵木糖醇的相对分子质量 ;
⑶各元素质量比C∶H∶O= 。
23.下面是实验室常见的制取气体的装置:
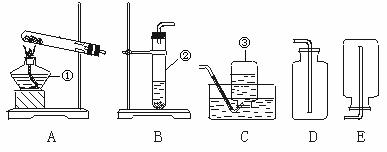
⑴写出标号仪器的名称
① ③
⑵实验室采用装置A制取氧气时,其试管中可装入高锰酸钾,这时试管口还要放一小团棉花,目的是 ,该反应的文字表达式是 。用该方法制取氧气的步骤包括:①连接仪器 ②装药品 ③将装有药品的试管固定在铁架台上 ④检查装置的气密性 ⑤加热 ⑥用排水法收集一瓶氧气 ⑦熄灭酒精灯 ⑧将导管移出水面,其正确顺序排列为: 。
⑶采用装置B制取氧气时,其试管中应放的药品是 ,所发生反应的文字表达式是 。
⑷收集氧气可以选择装置 或 ,原因是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com