
29. (15分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著地杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(15分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著地杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是 。
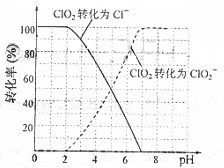
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-).2001年我国卫生部规定,饮用水ClO2-的含量应不超过0.2 mg·L-1。
饮用水中ClO2、ClO2-的含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如右图所示。当pH≤2.0时,ClO2-也能被I-
完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:
 2Na2S2O3+I2=Na2S4O6+2NaI
2Na2S2O3+I2=Na2S4O6+2NaI
 ①请写出pH≤2.0时,ClO2-与I-
①请写出pH≤2.0时,ClO2-与I-
反应的离子方程式 。
②请完成相应的实验步骤:
步骤1:准确量取VmL水样加入
到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0
步骤3:加入足量的KI晶体。
步骤4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5: 。
步骤6;再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
 ③根据上述分析数据,测得该饮用水样中的ClO2-的浓度为 mg·L-1(用含字母的代数式表示)。
③根据上述分析数据,测得该饮用水样中的ClO2-的浓度为 mg·L-1(用含字母的代数式表示)。
④若饮用水中ClO2-的含量超标,可向其中加入适量的Fe2将ClO2-还原为Cl- ,该反应的氧化产物是 (填化学式)
28. (12分) “速力菲”(主要成分:琥珀酸亚铁,呈暗黄色) 是
市场上一种常见的补铁药物。该药品不溶于水但能溶于人体
的胃酸中。
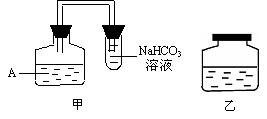
某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
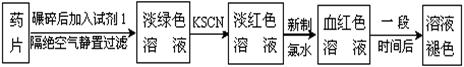
(1) 试剂1是 ,加入新制氯水后溶液中发生的离子反应方程式是:
, ;
(2) 加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是 ;
(3) 在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
|
编号 |
猜
想 |
|
甲 |
溶液中的+3价Fe又被还原为+2价Fe |
|
乙 |
溶液中的SCN-被过量的氯水氧化 |
|
丙 |
新制的氯水具有漂白性,将该溶液漂白 |
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的实验操作、预期现象和结论。(不一定填满,也可以补充)
|
编号 |
实验操作 |
预期现象和结论 |
|
① |
|
|
|
|
|
|
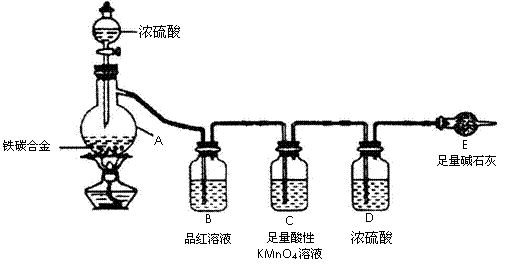
27. ( 17 分)现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置(夹持仪器已省略)和实
验方案进行实验探究。
 。
。
I测定铁的质量分数:
(1)称量E质量,并按图示连接装置;
(2)需不需要检查装置的气密性?_______(填“需要”或“不需要”);装置C的作用__________________________________________________________;
(3)将a g铁碳合金样品放入A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g,铁碳合金中铁的质量分数为____________________________(写表达式)
(4)某同学认为:依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,你认为可能的原因是 ___________。经过大家的讨论,决定采用下列装置和其他常用实验仪器测定某些数据即可,为了快速和准确的计算出铁的质量分数,最简便的实验操作是_______________(填写代号)。
①用排水法测定H2的体积
②反应结束后,过滤、洗涤、干燥、称量残渣的质量
③ 测定反应前后装置和药品的总质量
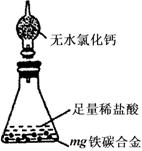 Ⅱ探究浓硫酸的某些性质:
Ⅱ探究浓硫酸的某些性质:
(5)未点燃酒精灯前,A、B 均无明显现象,其原因是:
__________;点燃酒精灯一段时间后,A、B 中 可观察到
明显的现象,B中的现象是____________;A中发生反应的化
学方程式(只写一个)__________ 。
26.(14分)为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验。
⑴ 若取ag样品,向其中加入足量的NaOH溶液,测得生成的气体体积为bL(标准状况,下同)。反应的化学方程式是____________________________
样品中铝的质量是_____________g。再向所得溶液中加入过量盐酸 ,反应的离子方程式是 , 。
⑵ 若取ag样品使其在高温条件下恰好完全反应,该反应的化学方程式是:_______________________,氧化铁和铝的质量比是_______________。
⑶ 待⑵中反应产物冷却后,加入足量盐酸,测得生成的气体体积为cL(标准状况),该气体与⑴中所得气体的体积比c:b=__________________
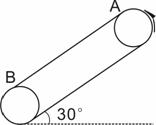
25.(20分)如图所示,皮带传动装置与水平面夹角为30°,轮半径R= m,两轮轴心相距L=3.75m,A、B分别是传送带与两轮的切点,轮缘与传送带之间不打滑。一个质量为0.1kg的小物块与传送带间的动摩擦因数为μ= 。g取10m/s2。
(1)当传送带沿逆时针方向以v1=3m/s的速度匀速运动时,将小物块无初速地放在A点后,它运动至B点需多长时间?(计算中可取≈16,≈20)
(2)小物块相对于传送带运动时,会在传送带上留下痕迹。当传送带沿逆时针方向匀速运动时,小物块无初速地放在A点,运动至B点飞出。要想使小物块在传送带上留下的痕迹最长,传送带匀速运动的速度v2至少多大?
24.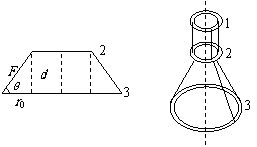 (18分)三根不可伸长的相同的轻绳,一端系在半径为r0的环1上,彼此间距相等,绳穿过半径为r0的第2个圆环,另一端同样地系在半径为2r0的环3上,如图所示,环1固定在水平面上,整个系统处于平衡状态.试求第2个环中心与第3个环中心之间的距离.(三个环都是用相同的金属丝制作的,摩擦不计)
(18分)三根不可伸长的相同的轻绳,一端系在半径为r0的环1上,彼此间距相等,绳穿过半径为r0的第2个圆环,另一端同样地系在半径为2r0的环3上,如图所示,环1固定在水平面上,整个系统处于平衡状态.试求第2个环中心与第3个环中心之间的距离.(三个环都是用相同的金属丝制作的,摩擦不计)
23.(16分)为了测定小木板和斜面间的动摩擦因数,某同学设计了如下的实验.在小木板上固定一个弹簧测力计(质量不计),弹簧测力计下端吊一个光滑小球,将木板连同小球一起放在斜面上,如图所示.用手固定住木板时,弹簧测力计的示数为F1,放手后木板沿斜面下滑,稳定时弹簧测力计的示数为F2,测得斜面倾角为θ,由测得的数据可求出木板与斜面间的动摩擦因数是多少?
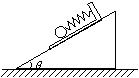
22.(1)某学生用打点计时器器小车的匀变速直线运动. 他将打点计时器接到频率为50Hz的交流电源上,实验时得到一条纸带. 他在纸带上便于测量的地方选取第一个计时点,在这点下标明A,第六个点下标明B,第十一个点下标明C,第十六个点下标明D,第二十一个点下标明E. 测量时发现B点已模糊不清,于是他测得AC长为14.56cm,CD长为11.15cm,DE长 为13.73cm,则打C点时小车的瞬时速度大小为 m/s,小车运动的加速度大小为 m/s2,AB的距离应为
 cm. (保留三位有效数字)
cm. (保留三位有效数字)
(2).关于验证牛顿运动定律的实验,下列说法中符合实际的是( )
A.通过同时改变小车的质量m及受到的拉力F的研究,能归纳出加速度、力、质量三者之间的关系
B.通过保持小车的质量不变,只改变小车的拉力的研究,就可以归纳出加速度、力、质量三者之间的关系
C.通过保持小车受力不变,只改变小车的质量的研究,就可以归纳出加速度、力、质量三者之间的关系
D.先不改变小车质量,研究加速度与力的关系;再不改变力,研究加速度与质量的关系,最后归纳出加速度、力、质量三者之间的关系
(3).在“验证牛顿运动定律”的实验中,作出了如图所示的(a)、(b)图像,图(a)中三线表示实验中小车的___________不同;图(b)中图线不过原点的原因是____________________________________________.


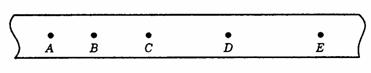
21.质点从A到B沿直线运动,已知初速为零,从A到中间某一点C的加速度为a1,方向与运动方向相同,从C到B的加速度大小为a2,方向与运动方向相反,到达B的速度恰好为零,AB=L,下列方法正确的是 ( )
A.A到B的平均速度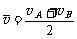 B.A到B的平均速度
B.A到B的平均速度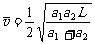
C.过C点的即时速度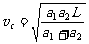 D.AC∶CB=a2∶a1
D.AC∶CB=a2∶a1
第Ⅱ卷(非选择题 共174分)
20.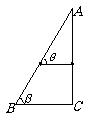 如图所示,用光滑的粗铁丝做成一直角三角形,BC边水平,AC边竖直,∠ABC=β.AB边及AC两边上分别套有用细线相连的铜环(其总长度小于
如图所示,用光滑的粗铁丝做成一直角三角形,BC边水平,AC边竖直,∠ABC=β.AB边及AC两边上分别套有用细线相连的铜环(其总长度小于
BC边长),当它们静止时,细线跟AB所成的角θ的大小为( )
A.θ=β B.θ=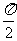
C.θ<β D.β<θ<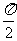
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com