
5.X、Y、Z是三种常见单质(其中Y为金属),M、N、R是三种常见氧化物(其中一种具有高熔点)。反应如下(未标条件,未配平): ;
;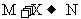 ;
; 则组成X单质的元素位于周期表中
则组成X单质的元素位于周期表中
A.第一周期
B.第二周期
C.第三周期 D.第四周期
4.下列叙述正确的是:
A.离子晶体中只含有离子,不可能含有分子
B.两种非金属元素组成的化合物一定是共价化合物
C.氮化硅陶瓷硬度大、熔点高、化学性质稳定,属于离子晶体
D.金刚石的熔点高于碳化硅,但低于氮化碳
3.下列离子方程式中正确的是
A.向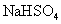 溶液中逐滴加入
溶液中逐滴加入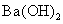 溶液至恰好呈中性
溶液至恰好呈中性
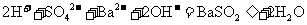

B.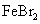 溶液中通入足量
溶液中通入足量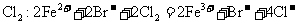

C.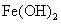 溶解于氢碘酸
溶解于氢碘酸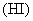 溶液中:
溶液中: 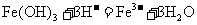

D.次氯酸钙溶液中通入过量二氧化碳
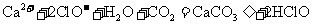

2.下列物质的粒子间既含有极性键又含有非极性键和分子间作用力且分子为非极性的是
A.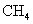 B.
B.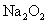 C.
C.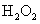 D.
D.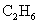

1.以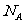 表示阿伏加德罗常数,下列说法中正确的是:
表示阿伏加德罗常数,下列说法中正确的是:
A.常温常压下,20gD2O中含有的原子总数大于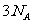

B.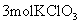 中含有的氯离子总数等于
中含有的氯离子总数等于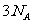

C.常温常压下,33.6L O2中含有的原子数小于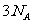

D.56g 铁粉与足量硫粉反应,失电子数等于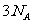

24、(8分)在120℃,10l kPa条件下,由H2、CH4、CO组成的混合气体a mL,通入一定量(设为 x mL)氧气使其完全燃烧。
(1)若a mL混合气体完全燃烧后消耗相同条件下氧气的体积也为a mL(即x=a mL),
则原混合气体中CH4的体积分数是 。
(2)若完全燃烧后生成CO2和H2O(g)的总体积在相同条件下为2 a mL ,则原混合气体中CH4的体积分数是 。现要测定原混合气体中H2的体积分数,还必须知道相同条件下的其他数据,可以是 (填选项字母)
A.2a mL混合气体的密度 B.生成CO2气体的总体积 C.生成H2O(g)的总质量
(3)若原混合气体完全燃烧所得气体中只有CO2和H2O(g),则x的取值范围是 。
2010届同升湖实验学校高三年级第三次月考
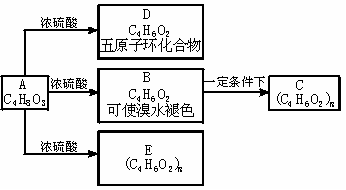
23、(14分)化合物C和E都是医用功能高分子材料,且有相同的元素百分组成,均可由化合物A(C4H8O3)制得,如下图所示,B和D互为同分异构体。
(1)写出A→D、B→C的化学方程式。
A→D:
B→C:
(2)写出A→B、B→C、A→E的反应类型:
A→B: ,B→C: ,A→E: 。
(3)E的结构简式 。
(4)A的同分异构体(同类型且有支链)的结构简式: 。
22、(5分)过碳酸钠(Na2CO4)和HCl反应的化学方程式为:
2Na2CO4+4HCl===4NaCl+2CO2↑+O2↑+2H2O
商品过碳酸钠中往往含有少量的碳酸钠,为了测定其纯度,现称取 0.9 g 样品进行实验。供实验用的仪器、试剂如下图
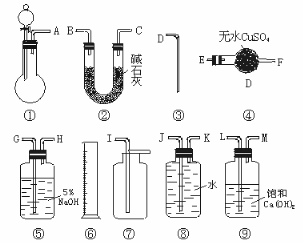
(1)为使实验尽可能简单,应选用的装置是_____ _______(填编号)。
(2)所选用的装置的连接顺序是______ ______(填字母)。
(3)为了能通过实验和计算,求得样品的纯度,所需测定的物质名称和物理量是 ,若所测定的物质的物理量以质量表示,且为m g ,则样品的纯度为 。
(4)实验室有50 mL 、100 mL、500 mL 三种规格的量筒,实验时选用的量筒的规格是____________。
21、(Ⅰ:6分;Ⅱ:6分,共12分)
Ⅰ:KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯。其变化可表述为: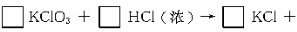

(1)请完成该化学方程式并配平(将未知物化学式和系数填入框内)
(2)浓盐酸在反应中显示出来的性质是 (填写编号,多选倒扣)。
A.只有还原性 B.还原性和酸性
C.只有氧化性 D.氧化性和酸性
(3)产生0.1 mol Cl2,则转移的电子的物质的量为 mol。
Ⅱ:某学生欲测定味精中食盐的含量。
(1)下面是该学生所做的有关实验步骤,请填写所缺的实验步骤②和④。
①称取某牌号的袋装味精样品5.0 g,并溶于蒸馏水。
② 。
③过滤。
④ 。
⑤将沉淀烘干、称量,测得固体质量为2.9 g。
(2)根据上述实验步骤回答下列有关问题:
①过滤操作所需要的仪器有: 。
②检验沉淀是否洗净的方法是 。
③烘干沉淀应采取的方法是: (填写编号)。
A.低温烘干 B.高温烘干 C.利用太阳能烘干
④若味精包装上标注:“谷氨酸单钠含量≥80%,NaCl含量≤20%”,则此样品是否符合产品标示的质量分数 (填“符合”或“不符合”)。
20、(10分)A、B、C、D为中学化学常见的物质,它们间的反应关系如下图所示。
(1)若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则B的化学式 ,有关反应的化学方程式为
。
(2)若B是正盐,D既可溶于盐酸又可溶于NaOH溶液。 当A是NaHCO3时,该反应的离子方程式为
。
(3)若A是碳化钙(CaC2),A与B的溶液反应时只生成气体C、CaCO3和水。 C的燃烧热为1300kJ/mol。则B的化学式为 :C燃烧的热化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com