
10. (1)O 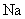
(2)
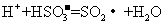
(3)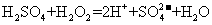
(4)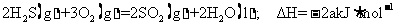
或: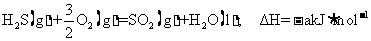
9. (1)氢,氮(写元素符号不得分)
(2)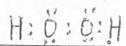
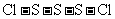
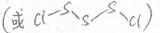
(3)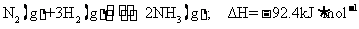
(或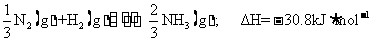
1. C 2.
D 3. A 4. D 5.B 6. C 7. B 8. D
12.(22分)已知A、B、C、D四种短周期元素的原子半径依次减少。在周期表中A与C
位于同一主族,B的最外层电子数为次外层电子数的2倍。C的最外层电子数是其电子
总数的3/4,D分别与B、C形成电子总数为10的化合物X、Y、D可与A形成化合物
Z。试问
答:
(1)A为_________;B为________;C为_________;D为_________。(填写元素名称)
(2)在Y、Z二种化合物中,沸点最低的是(用化学式表示,下同)_____________,热稳定性最强的是_____________________。
(3)Na2A的水溶液呈______________(酸性、中性、碱性),这是因为____________
(用离子方程式表示)。
(4)若由A、B、C、D四种元素中的两种组成化合物,化合物中分子的空间构型为直线型。写出符合上述要求且原子数不少于3的任意三种中学常见化合物的结构式:
_____________________、___________________、___________________。




















新都一中高2010级高三10月月考
理科综合试卷
化学
11.(16分)A、B、C、D、E、F、G是七种原子序数依次递增的短周期元素。A与B、C、
D均能分别形成10电子的共架化合物B1、C1、D1和18电子的共价化合物B2、C2、D2;D与E能形成两种离子化合物E1、E2,且晶体中阳离子与阴离子的个数比均为2:1;D与F的阴离子带有相同的电荷数;G的最外层电子数等于次外层电子数。
(1)B1的空间构型_________________型,C2的电子式___________________;
(2)A、C、D、F四种元素按原子个数比5:1:4:1组成的化合物的化学式为___________,
其水溶液呈_________性(填“酸”、“中”、“碱”),主要原因是(用方程式表示);
___________________________________。
(3)用电子式表示E1、E2的形成过程:_______________________________________。
(4)写出G的单质与D1反应的离子方程式:________________________________。
10.(12分)A、B、C、D为四种短周期元素,A、B、D的原子序数和原子半径均依次增大,这三种元素分别属于不同的周期,B、D同主族。A、B可以形成A2B和A2B2的两种通常情况下呈液态的共价化合物;B、C形成的两种离子化合物溶于水,其所得的溶液均呈强碱性;C的单质常温下可与A2B剧烈反应。试回答下列问题:
(1)元素符号:B___________,C___________;
B、C两元素形成的四核化合物X的电子式为_____________________。
(2)写出两种均含A、B、C、D四种元素的化合物相互间发生反应,且生成气体的离子方程式________________________________________________。
(3)为了除去A2DB4稀溶液中混有的A2DB3,常采用A2B2为氧化剂,发生反应的离子方程式为__________________________________________________。
(4)已知A、D两元素组成的化合物在B的单质中完全燃烧的燃烧热为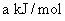 ,则燃烧时的热化学方程式为________________________________________________。
,则燃烧时的热化学方程式为________________________________________________。
9.(10分)有A、B、C、D、E、F六种元素,原子序数依次增大,位于不同的三个短周期,其中A与B、C可形成电子数相同的化合物,C与E可形成EC2、EC3化合物。在同周期元素中,B的离子半径最大,D的金属性最强,F的非金属性最强。
请回答:
(1)写出A、B的元素名称:A___________,B___________。
(2)A与C可形成具有弱酸性的化合物,该化合物的电子式为____________。
E与F可形成E3F2型化合物,该化合物的结构式为___________________。
(3)已知A、B的单质在一定条件下发生化合反应,1mol A单质完全反应,
放出30.8kJ的热量。该反应的热化学方程式是_____________________________
8.下列比较中,正确的是
A.受热稳定性: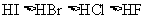 B.碱性:
B.碱性: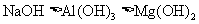

C.微粒半径: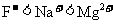 D.单质的熔点:
D.单质的熔点: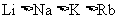 L
L


第II卷(共60分)
(考生请注意:以下答案必须写在化学答题卷上,否则不计分)
7.X、Y是元素周期VIIA族中的两种元素。下列叙述中能表明X的非金属性比Y强的是
A.Y的单质能将X从NaX的溶液中置换出来
B.X原子的电子层数比Y原子的电子层数少
C.X的氢化物的沸点比Y的氢化物的沸点低
D.X的气态氢化物稳定性比Y的气态化物稳定性低
6.有三种短周期元素,最外层电子数之和为17,质子数之和为31,如果这三种元素中有一种是氩元素,则关于另外两种元素说法不正确的是
A.如果一种元素的单质通常情况下是气体,则另一种元素的单质通常情况下是固体
B.如果一种元素的最高化合价是+3价,则另一种元素的单质有两种常见的同素异形体
C.如果一种元素是金属元素,则另一种元素一定是稀有气体
D.如果一种元素的气态氢化物是三角锥形分子,则另一种元素气态氢化物可能是正四面体型分子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com