
11、化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e- = Cl2
B.氢氧燃料电池的负极反应式: O2 + 2H2O + 4e-= 4OH-
C.在镀件上电镀锌,用锌作阴极
D.钢铁发生电化腐蚀的正极反应式:Fe-2e-= Fe2+
10、有X、Y、Z、M四种金属,已知:X可以从Y 的盐溶液中置换出Y;X和Z作原电池电
极时,Z为正极;Y和Z的离子共存于电解液中,Y离子先放电;M的离子的氧化性强于Y
的离子,则这四种金属的活动性由强到弱的顺序是
A.X >Y>Z>M B.X >Z>M>Y C.X>Z>Y>M D.M >Z>X>Y
9、体积相同的甲、乙两个容器中,分别充有2 mol SO2和1mol O2,在相同温度下发生反应
2SO2+O2 2SO3,并达到平衡.在该过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
2SO3,并达到平衡.在该过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
A.等于p% B.大于p% C.小于p% D.无法判断
8、已知常温下,N2(g)和H2(g)生成2 mol NH3(g)放出92.4 kJ热量。现有甲、乙两个容积相同
的密闭容器,在常温下:① 向密闭容器甲中通入1 mol N2和3 mol H2,达到平衡时放出热量
Q1 kJ。② 向密闭容器乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2 kJ。则下列
关系式正确的是
A.92.4>Ql>2Q2 B.92.4=Q1<2Q2 C.Q1=2Q2=92.4 D.Q1=2Q2<92.4
7、在锌和稀硫酸制氢气的反应中,不能使反应速率加快的措施是
A.加入少量硫酸铜 B.把锌粒换成等量锌粉 C.加热 D.加入少量氯化锌溶液
5、可逆反应2NO2 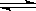 2NO + O2
在恒容密闭容器中反应,可以作为达到平衡状态的标志是
2NO + O2
在恒容密闭容器中反应,可以作为达到平衡状态的标志是
①单位时问内生成n mo1 O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③混合气体的颜色不再改变
④混合气体的密度不再改变
⑤混合气体的平均摩尔质量不再改变
A.①③④ B.②③④ C.①③⑤ D.①③④⑤
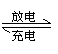
|
下列叙述不正确的是
A.充电时阳极反应为:Fe(OH)3-3e-+ 5 OH-= FeO42-+ 4H2O
B.充电时电池的正极和电源的正极相连
C.放电时正极反应为Zn-2e-+ 2OH-= Zn(OH)2
D.放电时每转移3 mol e-,有1 mol FeO42-被还原
4、下列说法正确的是
A.由C(石墨)→C(金刚石) ΔH=+1.9 kJ/mol 可知,石墨比金刚石稳定
B.1molH2SO4与足量氢氧化钠完全中和所放出的热量为中和热
C.原电池的两极一定是由活动性不同的两种金属组成
D.电解时电解池的阳极一定是阴离子放电
3、已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1) △H = ―Q1 KJ/mol
 2H2(g)+O2(g)==2H2O(g)
△H = ―Q2 KJ/mol
2H2(g)+O2(g)==2H2O(g)
△H = ―Q2 KJ/mol
 2H2(g)+O2(g)==2H2O(1)
△H = ―Q3KJ/mol
2H2(g)+O2(g)==2H2O(1)
△H = ―Q3KJ/mol
 常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则放出的热量为多少KJ
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则放出的热量为多少KJ
 A. 0.4Q1+0.05Q3 B. 0.4Q1+0.05Q2 C. 0.4Q1+0.1Q3 D. 0.4Q1+0.1Q2
A. 0.4Q1+0.05Q3 B. 0.4Q1+0.05Q2 C. 0.4Q1+0.1Q3 D. 0.4Q1+0.1Q2
2、已知反应2CO(g)= 2C(s)+ O2(g)的△H为正值,△S为负值,设△H和△S不随温度改变,对于该反应下列说法正确的是
A.低温下是自发变化 B.高温下是自发变化
C.任何温度下都是自发变化 D.任何温度下都是非自发变化
1、下列有关能量转换的说法正确的是
A.煤燃烧是热能转化为化学能的过程
B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com