
17.已知: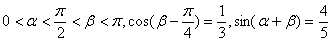 。
。
(1)求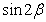 的值; (2)求
的值; (2)求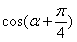 的值。
的值。
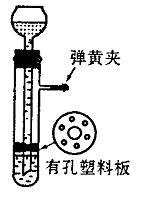
回答下列问题: (1)为什么关闭弹簧夹时试管中液面会下降? ____________________________________________________________________。 (2)这种制气装置在加入反应物前,怎样检查装置的气密性? ____________________________________________________________________。 (3)从下面三个反应中选择可以用这种随制随停的制气装置制取的气体,填写下表中的空白。 ①大理石与盐酸反应制取CO2 ②硫化亚铁与盐酸反应制取硫化氢 ③用二氧化锰催化分解过氧化氢制氧气
|
气体名称 |
离子反应方程式 |
收集方法 |
检验方法 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(4)食盐跟浓硫酸反应制取氯化氢不能用这种装置,试说明理由。 ____________________________________________________________________。 17.(13分)在一定条件下可实验下图所示物质之间的变化:
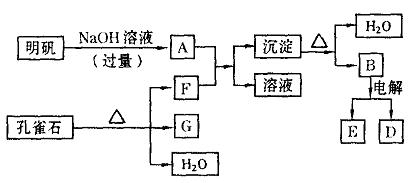
请填写下列空白: (1)孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解。上图中的F是____________。 (2)写出明矾与过量NaOH溶液反应的离子方程式:____________。 (3)图中所得G和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式____________。 (4)每生成1molD,同时生成____________mol E。 四、(本题包括2小题,共27分) 18.(16分)已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性。从溶液中将Cu2+、Fe2+、Fe3+沉淀为氢氧化物所需pH分别为6.4,6.4.3.7。现有某氯化铜晶体中含有FcCl2杂质,为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图所示步骤进行提纯。
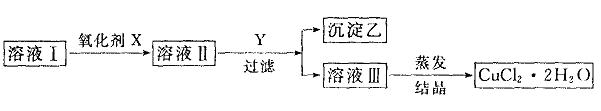
现有可供选择的试剂组(前X后Y): A.H2O2、CuO B.KMnO4、Cu(OH)2 C.NaClO、CuO D.K2Cr2O7、CuCO3 回答下列问题: (1)最适合本实验的试剂组是______________。 (2)加入氧化剂的目的是______________。 (3)本实验能否用加碱除去FeCl2?为什么? ____________________________________________________________。 (4)最后能否直接蒸发结晶?若不能,应如何操作? ____________________________________________________________。 19.(11分)某些金属氧化物跟熔融烧碱反应生成盐。根据以下化学反应框图填空:
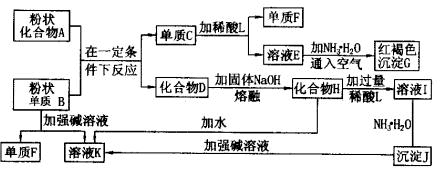
(1)单质F是 。 (2)写出由E生成G的离子反应方程式(或化学方程式) 。 (3)溶液I中所含金属离子是 。 (4)由C→E+F,若改用浓酸,则不能选用的浓酸是(写分子式) 。 五、(本题包括2小题,共16分) 20.(6分)铜是生命必需的元素,也是人类最早使用的金属之一,铜的生产和使用对国计民生各个方面产生了深远的影响。在化学反应中,铜元素可表现为0、+1、+2价。 (1)在西汉古籍中曾有记载:曾青得铁则化为铜[即:曾青(CuSO4)跟铁反应就生成铜]。试写出该反应的化学方程式: 。 (2)铜器表面有时会生成铜绿[Cu2(OH)2CO3],这层铜绿可用化学方法除去。试写出除去铜绿而不损伤器物的反应的化学方程式: 。 (3)新制的铜试剂[Cu(OH)2]与葡萄糖反应会生成红色沉淀,因此该试剂可用于检验糖尿病人尿液中葡萄糖的含量。葡萄糖的结构简式如下:
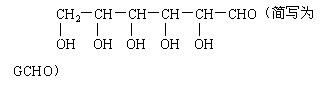
试写出GCHO与Cu(OH)2反应的化学方程式: 。 21.(10)分用下面两种方法可以制得白色的Fe(OH)2沉淀。 方法一: 用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。 (1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入 。 (2)除去蒸馏水中溶解的O2常采用 的方法。 (3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。 方法二: 在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
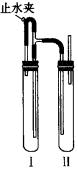
(1)在试管Ⅰ里加入的试剂是 。 (2)在试管Ⅱ里加入的试剂是 。 (3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。 (4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。 六、(本题包括2小题,共19分) 22.(9分)用15.5mL稀盐酸恰好能溶解4.24g带铁锈(Fe2O3)的铁片,生成的气体在标准状况下的体积为0.616L,向反应后的溶液中滴入少量的KSCN溶液不显红色。(1)求盐酸的物质的量浓度。(2)铁片里铁单质的质量分数。 23.(10分)把NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中后,有0.58g白色沉淀。在所得浊液中逐滴加入0.5mol/L盐酸,加入盐酸体积与生成沉淀的质量关系如图所示。试求:
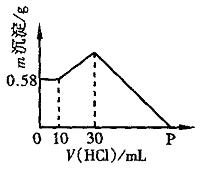
(1)混合物中NaOH质量是多少克? (2)混合物中AlCl3质量是多少克? (3)P点所表示的盐酸体积是多少毫升?
第 Ⅱ 卷 (非选择题共90分)
22.(14分)已知集合A={x||x-a|<ax,a>0},若f(x)=sinπx-cosπx,在A上是单调递增的函数,求a的取值范围。
21.(14分)已知ΔABC的三边长a=7, b=3, c=8,长为4的线段PQ以点A为中点,记 的夹角为θ,问当θ为何值时, 取得最值,其最值是多少?
20.(12分)已知 ,且
(1)求 ;
(2)求函数 的最小值和最大值。
19.(12分)已知ΔABC的三个顶点为A(2,5), B(-2,2), C(5,1)
(1)求角∠BAC的角平分线AD的长;
(2)在BC边上有一点P,使得SΔABP:SΔABC=1:3,求点P的坐标。
18.(11分)在ΔABC中,角A、B、C的对边分别为a、b、c,2sin2C=3cosC, ,又ΔABC的面积为 ,求:(1)角C的大小;(2)a+b的值。
17.(11分)在直角坐标系xoy中,已知点P(2cosx+1,2cos2x+2)和点Q(cosx,-1),其中x∈[0, π],若向量 垂直,求x的值。
15. 16.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com