
 下图表示的是我国五个省级行政区的煤、石油和天然气三种矿物能源占全国总储量的比例。读图回答1-3题。
下图表示的是我国五个省级行政区的煤、石油和天然气三种矿物能源占全国总储量的比例。读图回答1-3题。
1.A、B、C代表的矿物能源分别是
A.煤、石油和天然气
B.煤、天然气和石油
C.天然气、石油和煤
D.石油、天然气和煤
2.图中①、②、③代表的省级行政区可能是
A.山西、黑龙江、新疆
B.黑龙江、山西、新疆
C.黑龙江、新疆、山西
D.新疆、山西、黑龙江
3.③省(区)突出的环境问题是
A.水土流失 B.土地荒漠化 C.木材超采严重 D.草场退化
22.设数列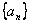 的前项和为
的前项和为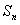 ,已知
,已知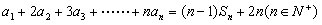 (1)求
(1)求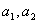 的值; (2)求证:数列
的值; (2)求证:数列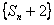 是等比数列; (3)抽去数列
是等比数列; (3)抽去数列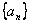 中的第1项,第4项,第7项,……,第
中的第1项,第4项,第7项,……,第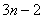 项,……,余下的项顺序不变,组成一个新数列
项,……,余下的项顺序不变,组成一个新数列 ,若
,若 的前项的和为
的前项的和为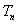 ,求证:
,求证: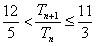 。
。
石室中学高2010级09年10月月考
21. 已知函数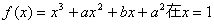 处取极值10。
处取极值10。
(I)求a,b的值; (II)过点(0,16)作曲线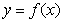 的切线,求切线方程。
的切线,求切线方程。
20. 已知定义在R上的函数f(x)=x2(ax-3),其中a为常数.(Ⅰ)若x=1是函数f(x)的一个极值点,求a的值;(Ⅱ)求函数f(x)的单调递减区间;(Ⅲ)若函数f(x)在区间(-1,0)上是增函数,求a的取值范围.
19. 设数列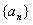 的前n项和为Sn=2n2,
的前n项和为Sn=2n2,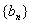 为等比数列,且
为等比数列,且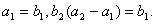
(1)求数列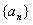 和
和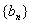 的通项公式;(2)设
的通项公式;(2)设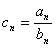 ,求数列
,求数列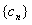 的前n项和Tn.
的前n项和Tn.
18.已知集合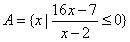 ,
,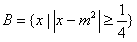 ,命题
,命题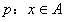 ,命题
,命题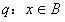 ,并且命题
,并且命题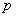 是命题
是命题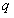 的充分条件,求实数
的充分条件,求实数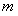 的取值范围。
的取值范围。
17.已知: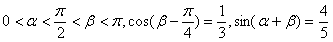 。
。
(1)求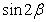 的值; (2)求
的值; (2)求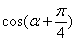 的值。
的值。
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较
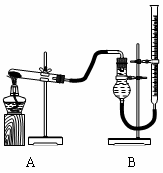 用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
|
实验序号 |
KClO3质量 |
其它物质质量 |
待测数据 |
|
④ |
1.2 g |
无其他物质 |
|
|
⑤ |
1.2 g |
CuO 0.5 g |
|
|
⑥ |
1.2 g |
MnO2 0.5 g |
|
回答下列问题:
⑶上述实验中的“待测数据”指_____________;
⑷本实验装置图中量气装置B由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是___________(填“酸式”或“碱式”)滴定管;
⑸若要证明实验⑤中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞,__________________________________________
___________________________________
_________________;
⑹为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a、_______________________________,b、CuO的化学性质有没有改变。

14.(8分)工业碳酸钠由于在生产过程中原料盐和工艺等的原因,常会含有Na2SO4 、NaCl中的一种或两种杂质。现有工业碳酸钠样品,某化学兴趣小组就工业碳酸钠中是否含有这两种杂质进行探究。
实验室有以下的仪器和药品可供使用:
烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹:1.0 mol·L-1H2SO4、1.0 mol·L-1HNO3、1.0mol·L-1HCl、NaOH稀溶液、0.1 mol·L-1AgNO3、0.1 mol·L-1BaCl2
、0.1 mol·LBa(NO3)2、蒸馏水。以下是部分实验探究过程:
(1)提出假设:根据题意,工业碳酸钠中含有杂质有______种可能的情况。
(2)设计实验方案
基于工业碳酸钠中两种杂质均存在这一假设,设计出实验方案(不要在答题卡上作答)。
(3)根据(2)的实验方案,进行实验。请在答题卡上按下表格式写出实验操作步骤、预期的现象及结论
|
编号 |
实验操作 |
预期现象和结论 |
|
① |
  |
|
|
② |
  |
|
|
③ |
  |
|
|
|
 |
|


15.(13分)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
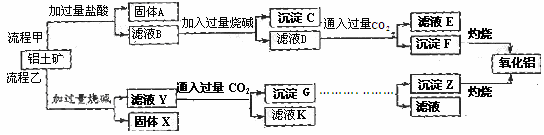
请回答下列问题:
(1)Fe的原子序数为26,Fe位于元素周期表中第_______周期,第______族。
(2)流程甲加入盐酸后生成Al3+的离子方程式为 。
(3)流程乙加入烧碱后生成SiO32-的离子方程式为 。
(4)写出检验滤液B中是否含铁离子的方法 。
(5)滤液E、K中溶质的主要成份是 (填化学式),写出该溶液的一种用途 。
(6)已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+) = 。
16.(12分)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO 2CO2+N2。
2CO2+N2。
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO)(mol/L) |
1.00×10-3 |
4.50×10-4 |
2.50×10-4 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
|
c(CO)(mol/L) |
3.60×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)前2s内的平均反应速率v(N2)= 。
(2)在该温度下,反应的平衡常数K= 。
(3)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
|
实验 编号 |
T(℃) |
NO初始浓度 (mol/L) |
CO初始浓度 (mol/L) |
催化剂的比表面积(m2/g) |
|
Ⅰ |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
|
Ⅱ |
|
|
|
124 |
|
Ⅲ |
350 |
|
|
124 |
①请在上表空格中填入剩余的实验条件数据。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号。
17. (9分)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是
。若电解电路中通过2mol电子,MnO2的理论产量为 。
18.[10分]苄佐卡因是一种医用麻醉药品,学名对氨基苯甲酸乙酯,它以对硝基甲苯为主要起始原料经下列反应制得:
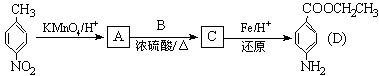
请回答下列问题:
(1)写出A、B、C的结构简式:A ,B ,C 。
(2)用1H核磁共振谱可以证明化合物C中有 种氢处于不同的化学环境。
(3)化合物C的部分同分异构体(E、F、G)的结构简式如下:
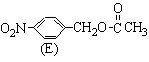 、
、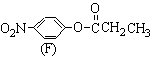 、
、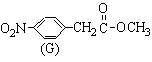 。
。
E、F、G中有一化合物经酸性水解,其中的一种产物能与FeCl3溶液发生显色反应,写出该水解反应的化学方程式 。
(4)苄佐卡因(D)的水解反应如下:
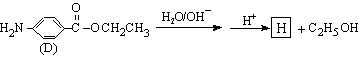
化合物H经聚合反应可制得高分子纤维,广泛用于通讯、导弹、宇航等领域。
请写出该聚合反应的化学方程式 。
(一)制取氧化铜
①称取2 gCuSO4·5H2O研细后倒入烧杯,加10 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题:
⑴上述实验步骤中需要使用玻璃棒的是_______________(填实验序号)
⑵步骤③中洗涤沉淀的操作是______________________________________________
9.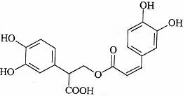 迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如右图。下列叙述正确的是
迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如右图。下列叙述正确的是
A.迷迭香酸属于芳香族化合物
B.1mol迷迭香酸最多能和9mol氢气发生加成反应
C.迷迭香酸可以发生水解反应、取代反应和酯化反应
D.1mol迷迭香酸最多能和含5mol NaOH的水溶液完全反应
10. 2SO2(g)+O2(g) 2SO3(g),⊿H<0 是制备硫酸的重要反应。下列叙述正确的是
2SO3(g),⊿H<0 是制备硫酸的重要反应。下列叙述正确的是
A.选用有效的催化剂能增大正反应速率并提高SO2的转化率
B.增大反应体系的压强、反应速率不一定增大。
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1-t2内,则SO3(g)生成的平均速率为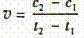

11.下列文字表述与反应方程式对应且正确的是
A.用惰性电极电解饱和氯化钠溶液:2Cl- + 2H+  H2↑+ Cl2↑
H2↑+ Cl2↑
B.用醋酸除去水垢:CaCO3 + 2H+==Ca2+
+ H2O + CO2↑
C.利用腐蚀法制作印刷线路板:2Fe3+ + Cu == 2Fe2+ + Cu2+
 D.实验室用液溴和苯在催化剂作用下制溴苯:
D.实验室用液溴和苯在催化剂作用下制溴苯: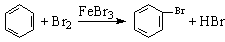

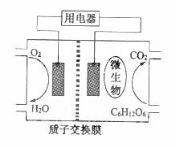
12. 科学家近年来研制出一种新型细菌燃料电池。以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是
A.该电池的负极反应为O2+2H2O+4e- =4OH-
B.电池的负极反应为:C6H12O6+6H2O =6CO2↑+24H++24e- C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体22.4L

13.(8分)某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com