
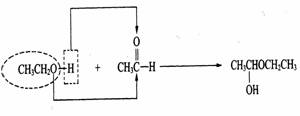
26.(10分)已知醇醛在一定条件下能发生缩合反应,示例如下:已知:
①有机物A,它的分子式为C13H18O7与一分子水作用,水解生成B和C。
②B能发生银镜反应,B也可由淀粉水解得到,B的分子式为C6H12O6
③C遇氯化铁溶液能发生显色反应,1molC与足量钠反应可产生1molH2。
 ④C在适当的条件下用氧化剂氧化,可得D,D的分子式为C7H6O3,相对分子质量D比C大14。
④C在适当的条件下用氧化剂氧化,可得D,D的分子式为C7H6O3,相对分子质量D比C大14。
⑤D有两个取代基,但不是间位,它与Br2在催化剂作用下发生一溴取代,产物有四种,D能与碳酸氢钠溶液反应。
⑥D与乙酸酐[(CH3CO)2O]反应,可得常见药物E和乙酸,E能与碳酸氢钠反应放出二氧化碳。
试回答下列问题:
(1)写出结构简式:C E 。
(2)写出与D互为同分异构体、含有苯环且含有酯结构的结构简式:
。(需写两种)
(3)B通常以六元环状结构存在,写出B的环状结构简式:
25. (12分)已知:HCN的结构为H-C≡N;
(12分)已知:HCN的结构为H-C≡N;
①R-CN RCOOH,
 ②R-Cl+CN-
R-CN+Cl-(R为烃基)。
②R-Cl+CN-
R-CN+Cl-(R为烃基)。
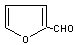 玉米芯、甘蔗渣等废物水解发酵后可制得糠醛
,它是重要的化工原料,它在一定条件下可发生以下变化:
玉米芯、甘蔗渣等废物水解发酵后可制得糠醛
,它是重要的化工原料,它在一定条件下可发生以下变化:
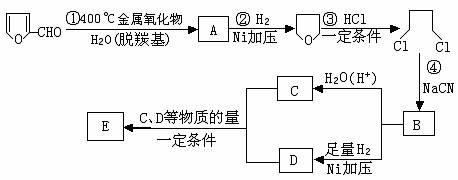
⑴写出反应类型:② ,④ 。
⑵写出反应③的化学方程式: ;
写出能证明糠醛中含有醛基的一个化学反应方程式
。
⑶若E为环状化合物,则其结构简式 。
⑷若E为高聚物,则其结构简式 。
24.(8分)某二元醇A,含氧的质量分数为27.1%,其余是碳和氢。A有如下图转化关系,在转化的过程中碳原子的连接方式可能会发生变化,A、B、C分子结构中都有4个甲基,且均为链状结构。(已知有机物中同一个碳上连接两个羟基不稳定)
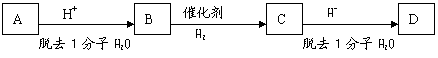
(1)A的相对分子质量是_________
(2)A和D的结构简式分别是________________和_______________________
(3)B转化为C的化学方程式是(用有机物的结构简式表示):
__________________________________________________________________
23.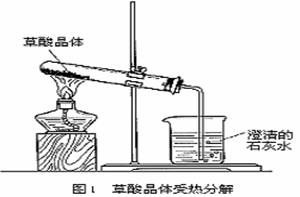 (12分)教科书:“如图1所示,给试管中的乙二酸晶体(H2C2O4·2H2O)加热,将分解产物先通入干燥的、冷的小烧杯中,然后再通入澄清的石灰水中,观察现象”。
(12分)教科书:“如图1所示,给试管中的乙二酸晶体(H2C2O4·2H2O)加热,将分解产物先通入干燥的、冷的小烧杯中,然后再通入澄清的石灰水中,观察现象”。
但在方案实施过程中,存在如下弊端:①试管口向下倾斜,乙二酸晶体熔化成液体,顺试管壁流向试管口,导致实验不能成功;②将分解产物通入干燥的、冷的小烧杯中,检验出来的水可能是乙二酸晶体分解出来的结晶水,不能证明乙二酸分解了;③乙二酸受热挥发出蒸气通入澄清的石灰水中,生成的CaC2O4是白色沉淀,对验证CO2有干扰,无法确证乙二酸分解;④乙二酸加热分解的产物可能为CO2、CO、H2O,其中CO是有毒气体,必须处理掉等。
针对以上情况,某研究性学习小组进行探究,设计出如下实验进行乙二酸的分解并测定其分解率,操作步骤如下:
①把乙二酸晶体放在烘箱中进行烘烤,去掉结晶水,备用。
②按图2连接好装置。
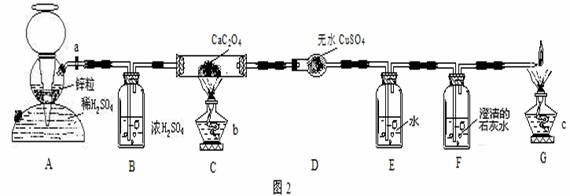
③检查装置的气密性。
④打开活塞a,通入H2一会儿,再关闭a;点燃酒精灯b、c。
⑤当C装置中固体消失后,停止加热
⑥打开活塞a,继续通入H2,直至冷却。
试回答下列问题:
⑴装置B的作用________________________________________________;
装置E的作用________________________________________________。
⑵检验该套装置气密性的方法是
_____________________________________________________________________。
⑶若移走装置A、B,会使所测乙二酸的分解率____(填“增大”、“减小”或“不变”)。
⑷可以代替装置G的方法是_____________________________________________。
⑸若称取H2C2O4(烘干)的质量为4.5g,实验结束后,称得D、E、F分别增重0.95g、0.40g、1.98g,则乙二酸的分解率为_______________。
22.(14分) 下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务。
I.课本介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
⑴小赵同学用化学方法替代“闻生成物的气味”来说明生成物的出现,该化学方法中所另加的试剂及出现的主要现象是:__________; 。(用所学的知识回答)
⑵小赵同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入足量的乙醛溶液,可以看到溴水褪色。该同学为解释上述现象,提出三种猜想:
①溴与乙醛发生取代反应;② ③由于醛基具有还原性,溴将乙醛氧化为乙酸。
为探究哪种猜想正确,小李同学提出了如下两种实验方案:
方案一:用pH试纸检测溴水褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br-离子的物质的量。
(3)方案一是否可行 (填“是”或“否”),理由是 。
(4)小李同学认为:假设测得反应前溴水中Br2的物质的量为amol,若测得反应后
n(Br-)= mol,则说明溴与乙醛发生取代反应。
(5)小吴同学设计如下实验方案:①按物质的量之比为1:5配制KBrO3-KBr溶液,加合适的适量的酸,完全反应并稀至1L,生成0.5molBr2。②取上述溶液10mL加入足量乙醛溶液,使之褪色,然后将所得溶液稀释为100mL,准确量取其中10mL。③加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到淡黄色固体0.188g。若已知CH3COOAg易溶于水。
试通过计算判断:溴与乙醛发生反应的化学方程式为
小张同学认为合适的酸既不是硫酸也不是盐酸,这是为什么?
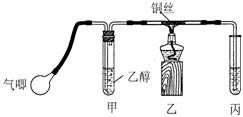 Ⅱ.小钱同学利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。
Ⅱ.小钱同学利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。
请填写下列空白:
⑴乙醇发生催化氧化的化学方程式为 。
 ⑵实验时,小钱同学将甲装置浸在70℃-80℃的水浴中,目的是
____。
⑵实验时,小钱同学将甲装置浸在70℃-80℃的水浴中,目的是
____。
小孙同学认为:由于小钱同学装置设计上的缺陷,实验进行时可能会 ____________。
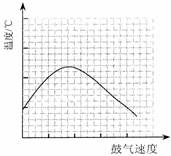
⑶反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步探究表明,鼓气速度与反应体系的温度关系曲线如图所示。
请你解释鼓气速度过快,反应体系温度反而下降的原因: 。
你认为该实验中“鼓气速度”这一变量可用 来计量。
21.(4分)下列有关实验的叙述,正确的是(填序号)
A、用NaOH溶液除去乙酸乙酯中混有的乙酸、乙醇,然后分液
B、分馏石油时,温度计的末端必须插入液面下
C、用分液漏斗分离环己烷和水的混合液体
D、用浓氨水洗涤做过银镜反应的试管
E、配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加到沉淀刚好溶解为止
F、蔗糖水解后,直接滴加新制氢氧化铜悬浊液并加热检验水解产物中的葡萄糖
20.无色的有机物I是印制防伪商标的一种原料,在紫外光辐射下I可转变成结构Ⅱ(显橙色),反应如下(R1、R2、R3是烃基):有关上述变化的说法不正确的是( )
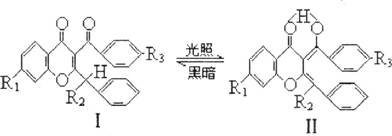
A.I和II互为同分异构体; B.I、Ⅱ分子中所有原子都可能在同一平面上;
C.II可看作醇类; D.Ⅱ能发生加成反应。
第ⅠI卷( 共80分)
19.将1mol 乙酸(其中的羟基氧用 18O 标记)在浓硫酸存在下并加热与足量乙醇充分反应。下列叙述不正确的是( )
A.生成的乙酸乙酯中含有18O B.生成的水分子中含有18O
C.可能生成 45g 乙酸乙酯 D.不可能生成 88g 乙酸乙酯
18.一些烷烃的燃烧热(KJ/mol)如下表:
|
化合物 |
燃烧热 |
化合物 |
燃烧热 |
|
甲烷 |
891.0 |
正丁烷 |
2878.0 |
|
乙烷 |
1560.8 |
异丁烷 |
2869.6 |
|
丙烷 |
2221.5 |
2-甲基丁烷 |
3531.3 |
下列表达正确的是( )
A.热稳定性:正丁烷<异丁烷
B.乙烷燃烧的热化学方程式为:
2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g) ΔH=-1560.8KJ/mol
C.正戊烷的燃烧热大约在3540 KJ/mol左右
D.相同质量的烷烃,碳的质量分数越大,完全燃烧放出的热量越多
17.新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式为:
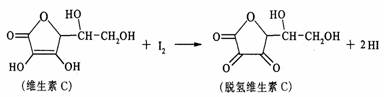
下列说法正确的是( )
A.上述反应为取代反应 B.滴定时可用淀粉溶液作指示剂
C.滴定时应剧烈振荡锥形瓶 D.脱氢维生素C的分子式为C6H6O6
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com