
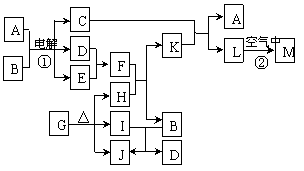
26、(18分)图表示各物质之间的转化关系。已知:常温下D、E、F、I、J为气体,且D、I是水煤气的主要成分;B是无色液体,M为红褐色固体,C的焰色反应为黄色。
(1)基于反应①原理的化学工业称为 ,写出该反应的化学方程式
(2)写出K和E反应的离子方程式_________。写出F溶液和H反应的离子方程式_____
__。
(3)已知:由G分解得到的H、I、J三者的物质的量之比为1∶1∶1,则G的化学式为 _ __。
(4)已知在稀溶液中1molC与1molF恰好完全反应放出akJ热量,写出该反应的热化学方程式 。
25、(12分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-®NO+2H2O。
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式 ;
(2)反应中硝酸体现了 性质;
(3)反应中若产生了0.2mol气体,则转移的电子的物质的量为 ;
 (4)若1mol甲与浓硝酸反应时消耗的硝酸物质的量将增加,其原因为:
。
(4)若1mol甲与浓硝酸反应时消耗的硝酸物质的量将增加,其原因为:
。
13.下列实验能达到预期目的的是
①向溴乙烷水解后的体系中加入足量的稀硝酸后加入AgNO3溶液,观察产生沉淀的情况以证明该反应属于取代反应
②除去苯中溶有的少量苯酚的方法是加入适量浓溴水,充分反应后,静置、过滤;
③除去FeCl3酸性溶液中少量的FeCl2可以采取的措施为加入稍过量双氧水后放置;
④鉴别硫酸根离子与亚硫酸根离子可以用硝酸酸化的硝酸钡溶液
⑤加入碳酸钠溶液产生沉淀和气体,再加盐酸白色沉淀消失,原溶液中不可能含有Al3+;
⑥误食重金属盐,可立即服用煮熟的鸡蛋清;
⑦工业制乙酸通常采用乙醛与新制的氢氧化铜悬浊液反应。
A.①②③⑦ B.①③ C.②③④ D.⑤②③⑥
第II卷(非选择题)
12.下列叙述正确的是
A.10 mL 0.1 mol/L NH4Cl溶液与5 mL 0.2 mol/L NaOH溶液混合:
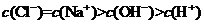
B.0.1mol/L PH为4的NaHB的溶液中,C(HB-)>C(H2B)>C(B2-)w.w.^ w.
C.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42-
D.相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸溶液中由水电离出的c (H+):①>②>③
11.已知反应mX(g)+nY(g)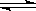 qZ(g),△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列有关说法正确的是
qZ(g),△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列有关说法正确的是
A.如果继续通入一定量某气体使体系压强增大,平衡将正向移动
B.此时,X的正反应速率是Y的逆反应速率的m/n倍
C.如果降低温度,且保持物质状态不发生改变,混合气体的平均相对分子质量变小
D.如果增加X的物质的量,平衡正向移动,X的转化率增大
10.下列有关硫酸工业生产的叙述正确的是
A.制造硫酸的三个阶段将依次用到的主要设备是:接触室、沸腾炉、吸收塔
B.在接触氧化中,实际选择的生产条件是高温(400℃-500℃)、常压 、铁触媒
C.一般硫酸厂建在原料产地比靠近硫酸消费中心更有利
D.生产硫酸的三个主要反应都是放热反应
9.短周期元素A、B、C,原子序数依次递增。已知:A、C同主族,而且三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是
A.原子半径:A<C<B
B.A氢化物的沸点低于C的氢化物
C.B元素在化合物中只能以阳离子的形式存在
D.5.6 g铁与足量的C在一定条件下化合,可转移0.3 mol电子
8.下列叙述正确的是
A.正四面体构型的分子中,键与键之间的夹角可以是109°28‘,例如金刚石中碳碳键之间的夹角
B.粒子间以分子间作用力结合而成的晶体其熔点一般不会很高
C.离子晶体中含有离子键,不能含有共价键
D.金属阳离子只能存在于离子晶体中
7.下列离子方程式中,不正确的是
A. 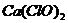 溶液中通入过量的
溶液中通入过量的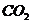 :
:
Ca2++2ClO-+2CO2+2H2O=Ca(HCO3)2+2HClO
B.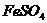 的酸性溶液中加入
的酸性溶液中加入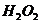 溶液:
溶液: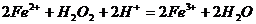
C.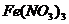 溶液中加过量氨水:
溶液中加过量氨水: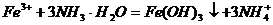
D.硫酸工业尾气处理中用氨水吸收过量的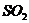 :
: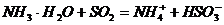
20.请以“这也是 ”为题目,写一篇不少于600字的文章。
要求:(1)请补全题目,然后写作;(2)文体不限,努力表达自己的真情实感;(3)文中不要出现真实的地名、校名、人名。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com