
1.易溶物向难溶物转化
如向BaCO3 沉淀中加入Na2CrO4溶液,将会发现白色的BaCO3 固体逐渐转化成黄色的 BaCrO4 沉淀。为什么产生这现象呢?
可根据溶度积规则分析。当加入少量CrO42-
时,c(Ba2+)·c(CrO42-)<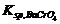 ,这时不生成BaCrO4沉淀。继续加入CrO42-,必将有一时刻刚好达到 Q =
,这时不生成BaCrO4沉淀。继续加入CrO42-,必将有一时刻刚好达到 Q =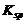 ,即 c(Ba2+)·c(CrO42-)=
,即 c(Ba2+)·c(CrO42-)=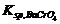 。这时,体系中同时存在两种平衡:
。这时,体系中同时存在两种平衡:
BaCO3  Ba2+ + CO32-
Ba2+ + CO32- 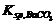 = c(Ba2+)·c(CO32-) = 2.58×10-9 …… ①
= c(Ba2+)·c(CO32-) = 2.58×10-9 …… ①
BaCrO3  Ba2+ + CrO42-
Ba2+ + CrO42- 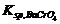 =
c(Ba2+)·c(CrO42-) = 1.6×10-10
……②
=
c(Ba2+)·c(CrO42-) = 1.6×10-10
……②
①-②
得:BaCO3
(s) + CrO42-  BaCrO3(s) + CO32-
……③
BaCrO3(s) + CO32-
……③
方程式③所表示的就是白色的BaCO3 转化成黄色的BaCrO4 的反应。其平衡常数为
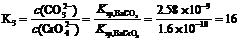
5.电解质溶液中的守恒规律
⑴电荷守恒规律:电解质溶液中,不论存在多少种离子,但溶液总是呈电中性,即阴离子所带负电荷总数一定等于阳离子所带正电荷总数,也就是所谓的电荷守恒规律。如NaHCO3溶液中存在着Na+、H+、HCO3-、CO32、OH-,必存在如下关系:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)。
⑵物料守恒规律:电解质溶液中,由于某些离子能够水解,离子种类增多,但某些关键性的原子总是守恒的,如K2S溶液中S2-、HS-都能水解,故S元素以S2-、HS-、H2S三种形式存在,它们之间有如下守恒关系:c(K+)=2c(S2-)+2c(HS-)+2c(H2S)。
⑶质子守恒规律:质子守恒是指电解质溶液中粒子电离出氢离子(H+)总数等于粒子接受的氢离子(H+)总数加游离的氢离子(H+)数。如Na2S水溶液中的质子转移作用可图示如下:
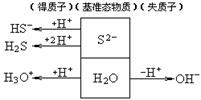
由上表可得Na2S水溶液中质子守恒式可表示为:c(H3O+)+2c(H2S)+c(HS-)=c(OH-)或c(H+)+2c(H2S)+c(HS-)=c(OH-)。质子守恒的关系式也可以从电荷守恒与物料守恒推导得到。
4.有关溶液pH的简单计算
在做关于溶液的pH计算的题目时,要抓住“矛盾的主要方面”,溶液显酸性用溶液中的c(H+)来计算;溶液显碱性先求溶液中的c(OH-),再求溶液中的c(H+)。口诀:酸按酸(H+),碱按碱(OH-),酸碱中和求过量,无限稀释7为限。特别注意区分溶液中的c(H+)和由水电离的c(H+)之间的差异,否则做题时,容易落入陷阱。
3.相同pH、相同体积的盐酸与醋酸的比较
|
|
c(H+) |
c(酸) |
中和碱 的能力 |
与过量Zn的反应情况 |
稀释相同倍数后的pH |
|
|
产生氢气 的量 |
开始时的 反应速率 |
|||||
|
盐酸 |
相等 |
小 |
弱 |
少 |
相等 |
大 |
|
醋酸 |
大 |
强 |
多 |
小 |
2.相同物质的量浓度、相同体积的盐酸与醋酸的比较
|
|
c(H+) |
pH |
中和碱 的能力 |
与过量Zn的反应情况 |
稀释相同倍数后的pH |
|
|
产生氢气 的量 |
开始时的 反应速率 |
|||||
|
盐酸 |
大 |
小 |
相等 |
相同 |
快 |
小 |
|
醋酸 |
小 |
大 |
慢 |
大 |
1.弱电解质的判断:以CH3COOH为例,可从以下角度来判断CH3COOH是弱电解质:
⑴0.1 mol·L-1的CH3COOH溶液,测其pH大于1。
⑵测CH3COONa溶液的pH大于7。
⑶取pH=3的CH3COOH溶液1 mL,用水稀释到100 mL后,测其pH小于5。
⑷pH相同的HCl和CH3COOH溶液,取相同体积分别用标准NaOH溶液测浓度,CH3COOH溶液消耗的NaOH溶液体积大。
⑸0.1 mol·L-1的HCl与过量的Mg反应,当加入CH3COONa晶体后,反应速率减慢,但生成氢气的总量不变。
⑹0.1 mol·L-1的CH3COOH和HCl溶液,分别与Mg反应,起始时CH3COOH溶液的反应速率慢。
⑺pH与体积均相同的HCl和CH3COOH溶液,分别与过量的Mg反应,生成氢气的总量CH3COOH大于HCl。
⑻pH相同的HCl和CH3COOH溶液与Mg反应,与CH3COOH溶液反应速率减小得慢。
⑼向pH=3的HCl溶液中加入CH3COONa晶体,其pH增大。
⑽分别测同体积0.1 mol·L-1的CH3COOH溶液和HCl溶液的导电性,HCl强于CH3COOH。
3.发生氧化还原的离子反应
溶液中常见的离子发生氧化还原反应的情况见下表(“√”表示能发生反应,“×”表示不能发生反应,括号内注“H+”表示酸性条件):
|
|
S2- |
SO32- |
I- |
Fe2+ |
Br- |
Cl-(H+) |
|
MnO4- |
√ |
√ |
√ |
√ |
√ |
√ |
|
ClO- |
√ |
√ |
√ |
√ |
√ |
√ |
|
NO3-(H+) |
√ |
√ |
√ |
√ |
√ |
× |
|
Fe3+ |
√ |
√ |
√ |
× |
× |
× |
2.酸碱性
|
溶液的酸碱性 |
溶液呈酸性 |
溶液呈碱性 |
溶液既可能呈酸性也可能呈碱性 |
|
可能的附加条件 |
溶液的pH小于7、加入甲基橙呈红色、加入较活泼金属(如Zn)有氢气生成等 |
溶液的pH大于7、加入酚酞溶液呈红色等 |
溶液中由水电离生成的c(H+)=10-12 mol·L-1 |
1.颜色
|
离子 |
MnO4- |
Fe3+ |
Fe2+ |
Cu2+ |
|
水溶液颜色 |
紫红色 |
黄色 |
浅绿色 |
蓝色 |
设错方式1:不符合客观事实,错写反应产物
如2Fe3++3S2-==Fe2S3,Fe3+有氧化性,S2-有还原性,Fe3+可将S2-氧化为S,即2Fe3++S2-==2Fe2++S↓
设错方式2:混淆化学式和离子式的书写形式。
如NH3通入醋酸溶液中:CH3COOH+NH3==CH3COONH4,错在未将强电解质拆分成CH3COO-、NH4+。
设错方式3:漏写部分离子反应。
如Ba(OH)2 溶液与H2SO4溶液反应:Ba2++SO42-==BaSO4↓,学生只注意了Ba2+与SO42-反应,而漏掉了H+与OH-的反应。
设错方式4:错写反应物或产物的配比关系。
如Ba(OH)2 溶液与H2SO4溶液反应:Ba2++OH-+H++SO42-==BaSO4↓+H2O,应写成Ba2++2OH-+2H++ SO42-==BaSO4↓+2H2O。
设错方式5:电荷不守恒或原子不守恒。
如Fe2++Cl2==Fe3++2Cl-,而应写成2Fe2++Cl2==2Fe3++2Cl-。
设错方式6:氧化还原反应中得失电子不守恒。
如2MnO4-+3H2O2+6H+==2Mn2++4O2↑+6H2O,而应写成2MnO4-+5H2O2+6H+==2Mn2++ 5O2↑+8H2O。
设错方式7:忽视了题设条件及要求。
如“过量”“少量”“等物质的量”“适量”“任意量”以及滴加顺序等对反应方程式或产物的影响。
如碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-==CaCO3↓+H2O,此反应中Ca(OH)2是二元碱,所以方程式中Ca2+和OH-的物质的量之比应为1︰2。
如碳酸氢钠溶液与足量石灰水反应:2 HCO3-+Ca2++2OH-====CaCO3↓+2H2O+CO32-,此反应中HCO3-充足,所以方程式中Ca2+和OH-的物质的量之比应为1︰1。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com