
9.(17分)Ⅰ、糖尿病是由于体内胰岛素紊乱导致的代谢紊乱综合症,以高血糖为主要标志。长期摄人高热量食品和缺少运动都易导致糖尿病。
(1)血糖是指血液中的葡萄糖(C6H12O6)。下列说法正确的是 (填字母序号)。
A.葡萄糖屑于碳水化合物,分子可表示为C6(H2O)6,则每个葡萄糖分子中含6个H2O
B.糖尿病人尿糖也高,可用新制的氢氧化铜悬浊液来检测病人尿液中的葡萄糖
C.葡萄糖可用于制镜工业
D.淀粉水解的最终产物是葡萄糖
(2)糖尿病人不可饮酒,酒精在肝脏内可被转化成有机物A。A的实验结果如下:
①通过样品的质谱测得A的相对分子质量为60。
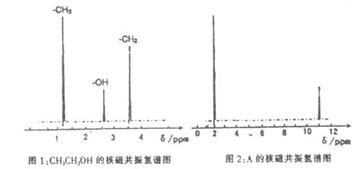 ②核磁共振氢原子光谱能对有机物分子中同性氢原子给出相同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:乙醇(CH3CH2OH)有三种氢原子(图1)。经测定,有机物A的按磁共振氢谱示意图如图2。
②核磁共振氢原子光谱能对有机物分子中同性氢原子给出相同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:乙醇(CH3CH2OH)有三种氢原子(图1)。经测定,有机物A的按磁共振氢谱示意图如图2。
③将A溶于水,滴入石蕊试液,发现溶液变红。
 试推导写出A的结构简式为
。
试推导写出A的结构简式为
。
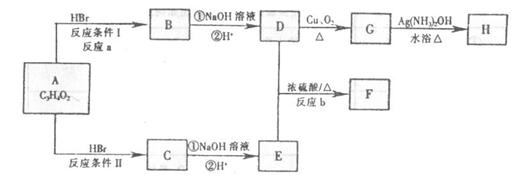
Ⅱ、已知物质A显酸性,F为七原子组成的环状结构,请根据以下框图回答问题:
(1) A、H的结构简式为 、 。
(2)a、b的反应类型分别为 、 。
(3)D和E生成F的化学方程式 。
(4)写出C的同分异构体中属于酯类物质的结构简式 、 (任写2种)。
8.(17分)红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛。
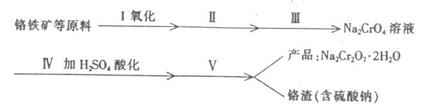 (1)实验室中红矾钠可用铬铁矿(主要成分:FeO·2Cr2O3)利用以下过程来制取。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·2Cr2O3)利用以下过程来制取。
①步骤Ⅰ中反应的化学方程式为:
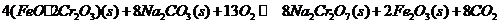
在常温下该反应速度极慢,下列措施中能使反应速率增大的是 。
A.升高温度 B.通入过量的氧气 C.将原料粉碎 D.增加纯碱的用量
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是 、 。
③步骤Ⅲ是除去Na2CrO4溶液中的杂质。
④步骤Ⅳ中发生反应的离子方程式为: 。
(2)将红矾钠与KCl固体按物质的量比为1:2混合溶于水后经适当操作可得到K2Cr2O7晶体。其溶解度随温度升高而升高且受温度影响大,请填写表中空格,探究制备过程。
|
序号 |
实验步骤 |
口述实验操作(不必叙述如何组装实验装置) |
|
① |
溶解 |
将混合物放入烧杯中,加水,充分搅拌直到固体不再溶解。 |
|
② |
|
|
|
③ |
|
|
|
④ |
|
|
|
⑤ |
过滤、干燥 |
得到K2Cr2O7晶体 |
(3)K2Cr2O7的酸性溶液具有很强的氧化性,试写出其与FeSO4溶液反应的离子方程式:
。
7.(11分)以下是25℃时几种难溶电解质的溶解度:
|
难溶电解质 |
Mg(OH)2 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
溶解度/g |
9×10-4 |
1.7×10-6 |
1.5×10-4 |
3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质。例如:
①为了除去氯化铵中的杂质FeCl3,先将混合物溶于水,再加入一定量的试剂充分反应后,过滤结晶即可;
②为了除去氯化镁晶体中的杂质FeCl3,先将混合物溶于水,加人足量的氢氧化镁,充分反应后,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质FeSO4,先将混合物溶于水,加入一定量的酸性H2O2溶液,将Fe2+化成Fe3+后,调升溶液的pH=4后,过滤结晶即可。
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为 (填化学式)而除去。
(2)①中加入的试剂应该选择 为宜,其原因是 。
(3)②中除去FeCl3,所发生反应的离子方程式为 。
(4)下列与方案③相关的叙述中,正确的是 (填字母序号)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调升溶液pH=4可选择的试剂是氢氧化铜
D.Cu2+不能大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
2.第Ⅱ卷共4页,用蓝、黑色墨水的钢笔或圆珠笔直接答在试卷上。
相对原子质量:H:1 C:12 N:14 O:16 Na:23
Mg:24 Al:27 S:32 Cl:35.5
第Ⅱ卷(非选择题 共64分)
1.答第Ⅱ卷前,考生务必将密封线内的项目和试卷第3页右上角的“座位号”填写清楚。
6.一定温度下,有可逆反应: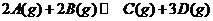 △H<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入体积为2V的乙容器。关于两容器中反应的说法正确的是( )。
△H<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入体积为2V的乙容器。关于两容器中反应的说法正确的是( )。
A.甲容器中的反应先达到化学平衡状态
B.在甲容器中再充入2molA和2molB,平衡向正反应方向移动,此时平衡常数增大
C.两容器达平衡后升高相同的温度,达到新的平衡,甲、乙容器中平衡混合物中各组分的体积分数不同
D.两容器中的反应均达平衡时,平衡混合物中各组分的体积分数相同,混合气体的平均相对分子质量也相同
|
座位号 (准考证号末两位) |
|
|
|
|
5.下面是常见的电化学装置图,①③④中均为惰性电极,下列说法正确的是( )。
A.装置①中阳极反应式为: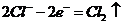 ,阴极反应式为:
,阴极反应式为: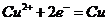 ,电解全后,溶液中的酸性增强
,电解全后,溶液中的酸性增强
B.装置②中铜片为阳极,若铜片和铁制品的质量相等,电解一段时间后,电路中有2mol电子转移,此时铜片和铁制品的质量差为128g
C.装置③中b极为负极,该极的电极反应方程式为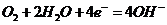
D.装置④中阳离子交换膜上每透过1molNa+时,则阴极上产生11.2L H2
3.下列各组溶液中,不用其它化学试剂,面用物质间两两混合的方法不可能鉴别出的是( )。
A.NaOH、AlCl3、盐酸、Na2CO3 B.BaCl2、AgNO3、Na2CO3、CaCl2
C.淀粉、淀粉和KI、KI、溴水 D.NaHCO3、稀硫酸、Na2SiO3、Na2SO3
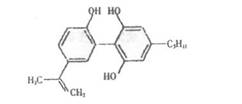 4.我国支持“人文奥运”的一个重要的体现是坚决反对运动员服用兴奋剂,某种兴奋剂的结构简式如图所示,有关该物质的说法不正确的是( )。
4.我国支持“人文奥运”的一个重要的体现是坚决反对运动员服用兴奋剂,某种兴奋剂的结构简式如图所示,有关该物质的说法不正确的是( )。
A.滴入酸性KMnO4溶液,紫色褪去,可证明结构中存在碳碳双键
B.1mol该物质与H2(一定条件下)反应时,最多消耗H2的物质的量为7mol
C.该分子中所有的碳原子不可能在同一平面上
D,该物质的分子式为C20H24O3,
2.下列说法不正确的是( )。
A.向鸡蛋白溶液中滴入饱和硫酸铵溶液,不会析出白色沉淀
B.向沸水中滴人饱和氧化铁溶液,能制取氢氧化铁胶体
C.浓硝酸溅在皮肤上能使皮肤呈现黄色,是由于浓硝酸和蛋白质发生了颜色反应
D.蛋白质在体内经消化后生成碳酸、硫酸、尿酸等,故它属于酸性食物
1.生活中碰到的某些问题,常涉及到一些化学知识,下列分析不正确的是( )。
A.Mg(OH)2和Al(OH)3均受热分解生成的气态水可覆盖火焰、驱逐O2、稀释可燃性气体,分解产物MgO和Al2O3能较快地与塑料燃烧过程中产生的酸性及腐蚀性气 体反应,所以它们可以作为未来发展方向的无机阻燃剂
B.用工业废弃物二氧化碳生产塑料,不会产生白色污染并有助于缓解温室效应
C.某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2
D.蒙古牧民喜欢用银器盛放鲜牛奶有其科学道理:用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com