
24、(7分)使一定量的锌与100mL18.5mol/L的浓硫酸充分反应,锌完全溶解,同时生成标准状况下的混合气体33.6L将反应后的溶液稀释至1L,测得溶液中H+的浓度为0.1mol/L求混合气体中的成分和各组分的体积比
桂林十八中09级高一下学期期中考试化学试卷
23、(3分)一定量的SO2与NaOH溶液反应,所得溶液中含Na2SO3与NaHSO3的物质的量之比为5︰3,则参加反应的SO2与NaOH的物质的量之比为
22、(10分)长期存放的亚硫酸钠可能会被部分氧化现通过实验来测定某无水亚硫酸钠试剂的纯度实验步骤如下:
①称量a g样品,置于烧杯中 ②加入适量蒸馏水,使样品溶解③加入稀盐酸,使溶液呈强酸性,再加过量的BaCl2溶液④过滤,用蒸馏水洗涤沉淀 ⑤加热干燥沉淀物 ⑥将沉淀物冷却至室温后,称量⑦重复⑤、⑥操作直到合格,最后得到b g固体
回答下面问题:
(1)本实验中是否能用Ba(NO3)2代替BaCl2?__________;其理由是_______________
(2)步骤③中加盐酸使溶液呈强酸性的目的是________________________________
(3)步骤⑦的“合格”标准是:_____________________________________________
(4)实验测得样品中无水亚硫酸钠占原有样品的质量分数是_________________(列出算式,不需化简)
21、(4分)下图是一套实验室制气装置,用于发生、干燥和收集气体下列各组物质中能利用这套装置进行实验的是 (填正确选项的标号)
|
|||
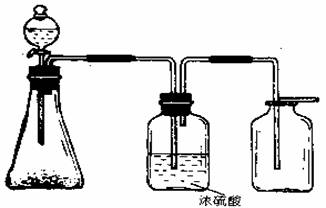 |
|||
20、(8分)现有A、B、C三种短周期元素,原子序数依次递增A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况)
请回答下列问题:
(l)B元素的符号________
(2)用电子式表示A与C形成的化合物的结构______________________
(3)A、B 、C三种元素最高价氧化物对应的水化物酸性渐强、碱性渐弱的顺序是(写化学式)_______________________________
(4)A、B、C三种元素的最高价氧化物对应的水化物之间可以发生反应,请写出其离子反应方程式:________________________________________________________________
______________________________________________________________________________________ _
19、(6分)
(1)在上面元素周期表中画出金属元素与非金属元素的分界线
(2)根据NaH的存在,有人提议可将氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可将氢元素放在周期表中的 族
(3)现有甲、乙两种元素,甲元素原子核外M层上有7个电子,乙元素的焰色反应显黄色
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应位置
② 甲元素与硫元素相比较,非金属性较强的是 (填元素名称),
写出可以验证该结论的一个化学反应方程式
18、(共8分)某溶液中可能存在的阴离子为下列离子中的一种或几种:


(1)若溶液呈强酸性时,则不能大量存在的离子是
(2)若加入Ba(NO3)2溶液后不生成沉淀,则溶液中不存在的离子是
(3)若加入盐酸和Ba(NO3)2的混合溶液,有大量的白色沉淀生成,则溶液中肯定存在的离子是
(4)若通入过量氯气,反应后的溶液中可能存在的离子是
17、(6分)2002年9月26日,中国北京曙光公司研制出了第一款具有完全我国自主知识产权的电子计算机服务器,在这台服务器上,奔腾的就是“龙芯”.
(1)“龙芯”(芯片)的主要成分是________
(2)在计算机长距离联网使用的传输很快的线路,其使用的材料叫________纤维,主要成分是________
(3)如果这种埋在地下的纤维裸露在碱性土壤中,结果会________,用离子反应方程式说明原因______________________________________________________________
16、下列在强酸性溶液中能大量共存,并且溶液为无色透明的离子组是 A. K+、Al3+、NO3-、SO42- B. K+、Fe2+、S2–、SO42–
C. NH4+、Na+、CO32-、Cl- D. Zn2+、Cu2+、MnO4–、SO42–
第Ⅱ卷(非选择题,共52分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com