
2、“ ”是“
”是“ ”的( )
”的( )
A.充分而不必要条件 B.必要而不充分条件
C.充要条件 D.既不充分也不必要条件
1、集合 =( )
=( )
A.{1,2,3} B.{0,2,3} C.{0,1,2} D.{0,1,3}
34. (12分)某植物花的颜色由两对
(12分)某植物花的颜色由两对
非等位基因A(a)和B(b)调控。
A基因控制色素合成(A:出现色素,
AA和Aa的效应相同),B为修饰基
因,淡化颜色的深度(B:修饰效应出
现,BB和Bb的效应不同)。现有亲
代P1(aaBB、白色)和P2(AAbb、红
色),杂交实验如图:
(1)上述杂交实验表明,A和a、B和b这两对基因在遗传过程中遵循 定律。若对F1植株进行单倍体育种,那么育出的植株的花色的表现型及比例是___________。
(2)F2中白花植株的基因型有_________种,其纯种个体在F2中大约占_______。
(3)F2红花植株中杂合体出现的几率是_______________。若对杂合的红花植株幼苗用秋水仙素处理,那么形成的植株为________倍体。
33.(14分)(1)在普通培养基中培养大肠杆菌,用紫外光照射,既可以获得抗紫外线的突变菌株,也可以获得抗青霉素的突变菌株。由此可以说明:基因突变具有_______________的特点。在含有青霉素的培养基的青霉素的培养基中能获得抗青霉素菌株,若抗青霉素的特性出现在接触青霉素之前,则青霉素起 作用;若抗青霉素的特性出现在接触青霉素之后,则青霉素可能起 和 作用。
(2)若将大肠肝菌的抗紫外线基因转到水稻体内,如何判断抗紫外线基因转入的是叶绿体内还是染色体上。
方法:
结果和结论:
①
②
32、(8分)下图是两个农业生态系统的结构简图.

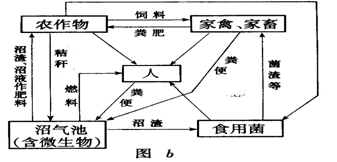

(1)a图中表示生态系统能量流动的箭头是___ __(填数字代号).
(2)b图中属于分解者的生物是______ __.
(3)b农业生态系统比a更科学合理,是因为① ;
② .
31、(8分)甲的细胞可产生抗体,乙表示正在出芽的酵母菌.
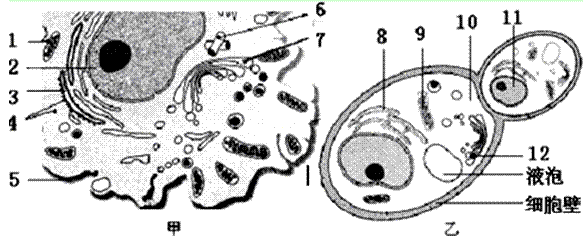
(1)甲和乙的细胞都属于 细胞.从图中看,与叶肉细胞的结构不同的是:甲和乙的细胞都 .
(2)甲的细胞可以由 分化而来.用数字标号和箭头,依序写出参与了抗体合成与分泌全过程的细胞结构: .
(3)酵母菌产生酒精的场所是 ,产生CO2的场所是 .(写出数字符号及结构名称)
(4)甲的细胞比乙的细胞代谢速率快,从结构方面找出两条原因:
① ;② .
30.(15分)与有机物B相关的反应信息如下:高☆考♂资♀源?网
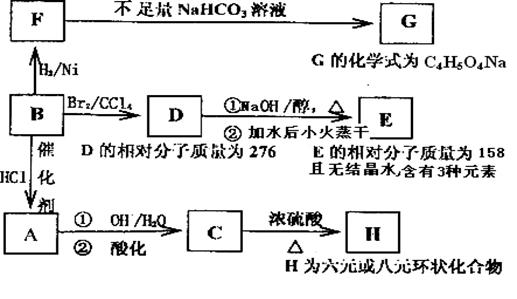
(1)写出下列反应的反应类型:C→H______________,B→D________________。
(2)写出E、C的结构简式:E_______________。C_______________。
(3)C的一种同分异构体K有如下特点:1molK可以和3mol金属钠发生反应放出33.6LH2(标准状况下),1molK可以和足量的NaHCO3溶液反应,生成1molCO2,1molK还可以发生银镜反应生成2moIAg,试写出K的所有结构简式(2个或2个以上羟基不可连在同一个碳上)
(4)写出在浓硫酸存在并加热的条件下,F与足量乙醇反应的化学方程式
________________________________________________________________。
(5)烃M的式量比B小20,已知M的结构中只含有一个官能团,只含有一个甲基,含有一个六元环,则M的同分异构体有 种
29.(16分)张明同学对硫酸及其盐的某些性质中进行了如下实验探究。
[实验一]探究浓硫酸的氧化性
将实验室常用的药品放入如右图所示的实验装置后,加热装置甲。(夹持和加热装置省略)
(1)该装置设计上存在明显缺陷,其缺陷是 。
(2)装置甲中反应的化学方程式是
(3)装置乙中的试剂是________________________________。
[实验二]探究某硫酸亚铁盐固体是否变质
(4)请你帮助张明同学完成如下实验方案:
|
实验操作 |
预期现象和结论 |
|
|
|
[实验三]用KHSO4制取H2O2并测其质量分数
查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如下:
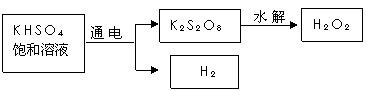
张明用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数:(离子方程式:2MnO4―+5H2O2+6H+=2Mn2++8H2O+5O2↑)
①取5.00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化;
②用0.1000 mol/L KMnO4溶液滴定;
③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL。
请回答:
(5)电解饱和KHSO4溶液时,阳极的电极反应式为____________________________。
(6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快。Mn2+的作用是_____________ ___。
(7)原H2O2溶液中溶质的质量分数是__________ _____ ____。
28.(14分)在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 molXY2含有54 mol电子。
(1)该融雪剂的化学式是 ;X与氢元素形成的化合物的电子式是 .
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是 ;D与E能形成一种非极性分子,该分子的结构式为 ;D所在族元素的氢化物中,沸点最低的是 .
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价健;W与Z能形成一种新型无机非金属材料,其化学式是 .
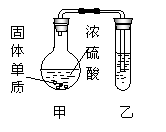 (4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为
.
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为
.
27.(15分)实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl:用水溶解,滤去残渣,滤液酸化后得到KMnO4和MnO2,请回答:
(1)软锰矿制备K2MnO4的化学方程式是 ;
(2)K2MnO4制备KMnO4的离子方程式是 ;
(3)若用2.5g软锰矿(含MnO280%)进行上述实验,计算KMnO4的理论产量;
(4)KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2该反应的化学方程式是 ;
(5)上述制得的KMnO4产品0.165g,恰好与0.335g钝Na2C2O4反应完全, 计算该KMnO4的纯度。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com