
7.天然气燃烧不完全会产生有毒气体CO,又知CO和CH4燃烧的热化学方程式分别为
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890 kJ·mol-1
又知由H2与O2反应生成液态H2O 比生成气态H2O 多放出44 kJ·mol-1的热量。则下列热化学方程式正确的是 ( )
A.2CH4(g)+O2(g)=CO2(g)+CO(g)+4H2O(l) ΔH=-1214 kJ·mol-1
B.2CH4(g)+O2(g)=CO2(g)+CO(g)+4H2O(g) ΔH=-1038 kJ·mol-1
C.3CH4(g)+5O2(g)=CO2(g)+2CO(g)+6H2O(l) ΔH=-1538 kJ·mol-1
D.3CH4(g)+5O2(g)=CO2(g)+2CO(g)+6H2O(g) ΔH=-1840 kJ·mol-1
[猜题理由]化学反应既伴随物质变化,又伴随能量变化,而且遵循能量守恒,这是化学常识。用热化学方程式来体现这一常识是学习化学的基本思想,同时运用盖斯定律进行有关反应热的计算,它能考查学生应用理论和计算的能力。
6.下列物质结构、性质的比较顺序正确的是:
A.金属性:Mg>Al>Na>Ca
B.非金属性:F>O>S>P
C.碱性:KOH>NaOH>Al(OH)2>Ca(OH)2
D.氢化物稳定性: HF>HCl>H2S>SiH4>PH3
[猜题理由]元素性质原子结构、元素周期律有着密切关系,通过对碱金属与卤素的学习,学生学会迁移应用,对其他主族元素性质进行推理。
5.下列离子方程式书写正确的是
A. Ba(OH)2溶液与过量的NaHCO3溶液混合
Ba2++2OH-+2HCO3- BaCO3↓+CO32-+H2O
BaCO3↓+CO32-+H2O
B.次氯酸钙溶液中通入少量SO2气体:
Ca2++2ClO-+SO2+H2O CaSO3↓+2HClO
CaSO3↓+2HClO
C.金属钾与水反应 K +2 H2O K+
+2 OH-+
H2↑
K+
+2 OH-+
H2↑
D.醋酸与氢氧化钠溶液的反应 H+ + OH- H2O
H2O
[猜题理由]离子方程式书写的正确与否,不仅仅是一个书写技巧的问题,实际上,它还涉及对反应物和产物的物态、溶解性、氧化还原性、电离情况等物理化学性质的理解。书写时还注意反应式反应前后物质的质量守恒和电性守恒。所以这种内容的题目可以考查考生对“双基”的掌握和综合运用化学知识的能力。
4.下列各组离子一定能大量共存的是( )
A.在含大量Al3+的溶液中:Ca2+、Na+、Cl-、HCO3-
B.在强碱溶液中:Na+、K+、AlO2-、CO32-
C.在c(H+)=10-12 mol/L的溶液中:NH4+、Mg2+、SO42-、NO3-
D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
[猜题理由]离子共存是历年高考化学试题中常见的传统题型。本题是要判断在四种条件下可以大量共存的离子。本题考查有关溶液中离子反应,以及考查对所学知识进行分析,判断的能力。
3.设NA代表阿伏加德罗常数的数值。下列有关叙述正确的是( )
①标准状况下,2.24LH2O含有的分子数等于0.1NA
②23gNa在氧气中完全燃烧失电子数为NA
③1 m ol 硫酸钾中阴离子所带电荷数为NA
ol 硫酸钾中阴离子所带电荷数为NA
④常温常压下,32gO2-离子中所含电子的数目为16 NA
⑤由CO2和O2组成的混合物中共有个NA分子,其中的氧原子数为2 NA
⑥1mol CO2分子中共价键总数为2 NA
A.①②⑤ B.②⑤ C.③④⑤ D.②⑥
[猜题理由]阿伏加德罗常数是高考常考知识点,也是常考题型之一。以阿伏伽德罗常数为依托可考查多个知识点,综合性较强。该题考查知识点中包含以物质的量为核心的简单计算。
2.下列各组离子,在指定条件下,一定能大量共存的是:
①某无色透明的酸性溶液中:Cl-、Na+、CrO42-、SO42-
②水电离产生的c(H+)=10-12mol·L-1的溶液中:K+、Ba2+、Cl-、NO3-
③使紫色石蕊试液变红的溶液中:Fe2+、Mg2+、NO3-、Cl-
④加入过量NaOH溶液后可得到澄清溶液:K+、Ba2+、 HCO3-、C1-
⑤c(H+)<c(OH-)的溶液中:ClO-、Cl-、K+、Na+
⑥在酸性高锰酸钾溶液中:Na+、NH4+、I-、ClO-
⑦能使pH试纸变深蓝色的溶液中:Na+、AlO2-、K+、CO32-
A.①③④⑥⑦ B.②③⑤⑦ C.②⑤⑦ D.②④⑤⑦
[猜题理由]离子共存是高考的常考题型,限制条件下的离子共存考查更受青睐。
1.2009年12月7日-18日在丹麦首都哥本哈根召开了世界气候大会,商讨《京都议定书》一期承诺到期后的后续方案,即2012年至2020年的全球减排协议,大会倡导“节能减排” 和“低碳经济”的绿色环保主题,中国宣布了2020年二氧化碳排放量下降40-45%的减排目标。下列不符合这一主题的是( )
A.自备购物布袋,不用塑料方便袋
B.开发新能源,如太阳能、风能等,减少对化石能源的依赖
C.推广煤的气化、液化技术,提供清洁燃料和化工原料
D.给汽车安装尾气处理器
[猜题理由]化学高考试题中的信息题常常和时事联系很紧密。比如说,1998年山西朔州发生假酒案,当年的全国化学高考题就考了有关甲醇的试题;1999年,我国许多城市禁止汽车使用含铅汽油,当年在全国化学高考试题中考查了有关试题;现代战争中常常用到石墨炸弹。石墨炸弹爆炸时能在方圆几百米范围内撤下大量石墨纤维,造成输电线、电厂设备损坏。1999年在全国高考化学试题中考查了有关试题;1999年欧洲的二噁英事件,2000年的全国化学高考题中就出现了有关二噁英的试题;2003年非典事件,2004年考了预防非典的消毒药物过氧乙酸的试题;2005年苏丹红事件,2005年化学高考考查了有关苏丹红的分子结构及有关试题;再比如高考还考了吗啡,海洛因的分子结构及其有关性质。2006年禽流感是影响全球的大事件,在高考中出现了根据治疗禽流感的药物达菲原料莽草酸的结构的试题。2008年的北京奥运会,又出了祥云火炬的燃料丙烷方面的试题等等。
现在的环境污染问题越来越受到全世界人们的关注和担忧,2009年12月7日-18日在丹麦首都哥本哈根召开了世界气候大会,商讨《京都议定书》一期承诺到期后的后续方案,即2012年至2020年的全球减排协议,大会倡导“节能减排” 和“低碳经济” 的绿色环保主题。 中国宣布了2020年二氧化碳排放量下降40-45%的减排目标,在这一目标的鼓舞下,低碳生活将逐渐成为时代的新时尚,为此我编写此题,预想在2010年的高考试卷中会有体现。
15、下图是实验室常用的实验仪器。请回答下列问题:
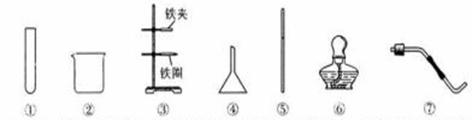
(1)配制一定溶质质量分数的NaCl溶液时,要溶解已称好的NaCl固体,就选择的仪器是 (填序号)。
(2)进行过滤操作时,除选用上述有关仪器外,还缺少的一种实验用品是 ,仪器⑤所起的作用是 。下列混合物的分离能直接用过滤的方法完成的是 (填序号)。
A.从酒精溶液中分离出酒精
B.从浑浊的河水中分离出泥沙
C.从海水中分离出氯化镁
(3)实验室用高锰酸钾制取氧气时,应选择的实验仪器是 (填序号)。
[解析]溶解固体时为加快溶解速度,用玻璃棒搅拌;过滤法分离混合物要求一者可溶,一者不溶。
[答案](1)②⑤
(2)滤纸 引流 B
(3)①③⑥⑦或①③⑥
14、下图是小梅配制100g溶质质量分数为12%的NaCl溶液的实验操作示意图如图所示:
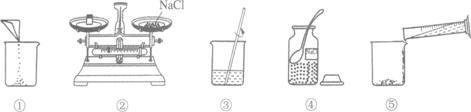
(1)上图中的玻璃仪器分别是广口瓶、量筒、烧杯和_______________。
(2)指出图中的一处错误操作___________________________________。
(3)配制时应选择_______mL(10mL或50mL或100mL)的量筒量取所需要的水。
(4)用上述图示的序号表示配制溶液的操作顺序___________________。
[答案](1)玻璃棒;
(2)装置②中氯化钠与砝码的位置颠倒了;
(3)100;(4)④②①⑤③。
13、海洋是丰富的化学资源宝库。通过晾晒海水,可以得到含少量泥沙的粗盐。未来得到纯净的NaCl(不考虑可溶性杂质),设计了如图所示的实验操作:
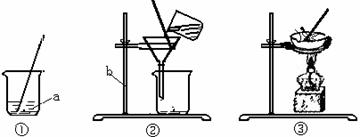
(1)上图有标号的仪器名称分别是a ,b 。
(2)操作②的名称是 ,玻璃棒的作用是 。
(3)操作③中看到 时,停止加热。
(4)称取5.0gNaCl固体,可配制溶质质量分数为10%NaCl溶液 g。
[解析](3)当蒸发皿中出现较多量固体时,停止加热,利用预热将剩余的水分蒸干(4)配制NaCL溶液:5.0g÷10%=50g。
[答案](1)烧杯 铁架台
(2)过滤 引流
(3)蒸发皿中出现较多量固体
(4)50
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com