
6.此次日食发生时,旅游者在日食带地区拍摄到的自然景观照片,天空背景的蔚蓝色逐步变得灰蒙蒙的,其主要原因是由于大气对太阳辐射的
A.保温作用的增加 B.反射作用的增强
 折射作用的减弱 D.散射作用的减弱
折射作用的减弱 D.散射作用的减弱
5.日全食现象发生时
A.太阳、月球、地球在一直线上 B.太阳系八大行星运行到一条直线附近
 地球位于太阳与月球之间 D.太阳位于月球与地球之间
地球位于太阳与月球之间 D.太阳位于月球与地球之间
4.若到2100年全球增温3℃-4℃,则我国
A.三江平原水稻种植面积扩大 B.春小麦种植范围向南扩展
 南方山地毛竹分布的海拔高度降低 D.辽东半岛适宜种植甜菜的面积扩大
南方山地毛竹分布的海拔高度降低 D.辽东半岛适宜种植甜菜的面积扩大
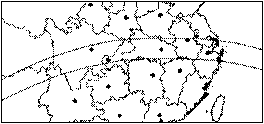 2009年7月22日上午9时左右,千年
2009年7月22日上午9时左右,千年
一遇的日全食将在我国的长江流域上演。
目前,江苏的苏州,浙江的嘉兴、杭州、
上海、安徽的铜陵等城市成为“日全食经
济圈”。 读右下“日全食自西向东扫过我
国的地区示意图”,根据材料回答5-7题。
3.对E值要求最高的作物是
A.油菜 B.水稻  甜菜 D.小麦
甜菜 D.小麦
2.若图所示是以极点为中心的俯视图,且M、N所在经线两侧
为不同日期,则此时北京时间为
A.0:00 B.8:00
 16:00 D.20:00
16:00 D.20:00
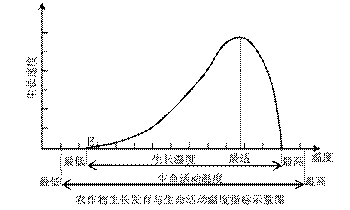 热量条件制约着农作物的种类和分布范围。读下图,完成第3-4题。
热量条件制约着农作物的种类和分布范围。读下图,完成第3-4题。
1. 若图所示是地球侧视图,MN为赤道,图示部分
既是西半球又是夜半球,且北京正午人影将越来越
长,则此时北京时间为
A.3月21日3:20 B.3月21日15:20
 9月23日3:20 D.9月23日15:20
9月23日3:20 D.9月23日15:20
7.某工厂废水中含5.00×10-3 mol·L-1的Cr2O72-,毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4,设计了如下实验:
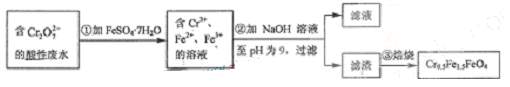
第1步反应的离子方程式是 。
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
单晶硅是信息产业中重要的基础材料。通常在高温下还原二氧化硅制得粗硅(含铁、CO等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃)四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
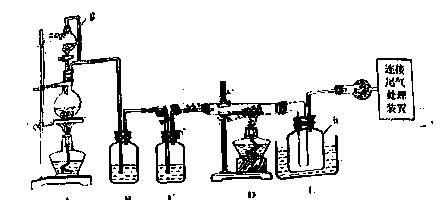
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
|
物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
|
沸点/℃ |
57.7 |
12.8 |
- |
315 |
- |
|
熔点/℃ |
-70.0 |
-107.2 |
- |
- |
- |
|
升华温度/℃ |
- |
- |
180 |
300 |
162 |
 d.已知装置A中发生反应的方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
d.已知装置A中发生反应的方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
请回答下列问题:
(1)装置A中g管的作用是______________;装置C中的试剂是____________;装置E中的h 瓶需要冷却的理由是______________。
(2)装置E中h瓶收集到的粗产物可通过酒精(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是______________(填写元素符号)。
6.该小组根据上述原理设计下图所示装置制备Na2S2O3。
|


|
|

|
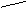
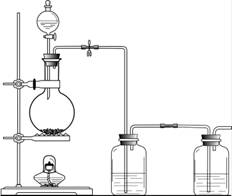
(1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是
① ;
② 。
(2)实验过程中,随着气体的通入,装置①中有气泡产生,还有大量黄色固体析出,继续通入气体,可以观察到的现象是 。
(3)反应结束后,从制得的Na2S2O3稀溶液中得到Na2S2O3·5H2O晶体的主要操作包括: 。
4.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。
某科研小组用电浮选凝聚法处理污水,设计装置示意图如下:
|
|
|
|
|
|
|
|
|
|
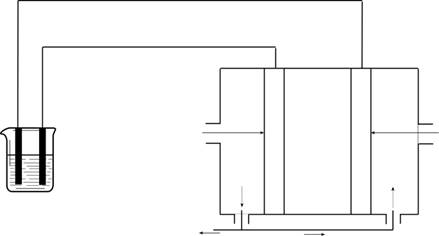
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的 。
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH e.CH3CH2OH
(2)电解池阳极的电极反应分别是① ;
②4OH- - 4 e-= 2H2O + O2↑。
(3)电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是
。
(4)该熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。
(5)已知负极的电极反应是CH4 + 4CO32- - 8e-= 5CO2 + 2H2O。
①正极的电极反应是 。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是 。
I.某校化学实验小组探究浓度对化学反应速率的影响,并测定(NH4)2S2O8和KI反应的化学反应速率。进行如下实验探究:
[实验原理]
(NH4)2S2O8和KI反应的离子方程式为:
 S2O82- + 2I- 2SO42- + I2 (1)
S2O82- + 2I- 2SO42- + I2 (1)
平均反应速率的计算式为v(S2O82-)= 。
实验时,向KI、Na2S2O3和淀粉指示剂混合溶液中加入(NH4)2S2O8溶液,不断搅拌。
在反应(1)进行的同时,发生反应:
2S2O32-+ I2 S4O62-+ 2I- (2)
反应(1)生成的I2立即与S2O32-反应,生成无色的S4O62-和I-。S2O32-耗尽时,反应(1)继续生成的I2才与淀粉作用呈现蓝色。从加入(NH4)2S2O8溶液到出现蓝色的时间为Δt。
[实验内容]
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
|
实 验 编 号 |
① |
② |
③ |
④ |
⑤ |
|
|
试剂 用量 (mL) |
0.20 mol·L-1 (NH4)2S2O8溶液 |
20.0 |
10.0 |
b |
20.0 |
20.0 |
|
0.20 mol·L-1 KI溶液 |
20.0 |
20.0 |
20.0 |
10.0 |
5.0 |
|
|
0.010 mol·L-1 Na2S2O3溶液 |
a |
8.0 |
8.0 |
8.0 |
8.0 |
|
|
0.2% 淀粉溶液 |
2.0 |
2.0 |
2.0 |
2.0 |
2.0 |
|
|
0.20 mol·L-1KNO3溶液 |
0 |
0 |
0 |
10.0 |
c |
|
|
0.20 mol·L-1(NH4)2SO4溶液 |
0 |
10.0 |
15.0 |
0 |
0 |
|
|
20 ℃时,反应时间Δt(s) |
32 |
67 |
130 |
66 |
135 |
|
|
为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 |
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是
。
(3)第①组实验的v(S2O82-)= mol· (L·s)-1。
(4)根据上表数据分析,可以得到的结论有(写出一条即可)
。
II.实验小组查资料得知,向含有Na2CO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:
Na2CO3 + SO2 Na2SO3 + CO2
2Na2S + 3SO2 2Na2SO3 + 3S↓
Na2SO3 + S Na2S2O3
3.W、X、Y、Z均为短周期主族元素,W的最外层电子数与核外电子总数之比为3:8;X的核外电子总数与Y的最外层电子数相等,X的原子序数是Z的原子序数的一半;W、Y、Z位于同一周期。
W、Y、Z三种元素的气态氢化物稳定性由高到低的顺序是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com