
2.下列根据反应原理设计的应用,不正确的是 ( )
A.CO32- + H2O 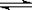 HCO3-+ OH错误!链接无效。
热的纯碱溶液清洗油污
HCO3-+ OH错误!链接无效。
热的纯碱溶液清洗油污
B.Al3+ + 3H2O
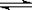 Al(OH)3 + H+ 明矾净水
Al(OH)3 + H+ 明矾净水
C.TiCl4+ (x+2)H2O(过量) 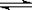 TiO2·x H2O↓ + 4HCl 用TiCl4制备TiO2
TiO2·x H2O↓ + 4HCl 用TiCl4制备TiO2
D.SnCl2 + H2O 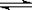 Sn(OH)Cl↓ + HCl 配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl↓ + HCl 配制氯化亚锡溶液时加入氢氧化钠
1.生石灰与氯化铵反应生成氨气的化学方程式为 。
6.常温下,在25 mL 0.1 mol·L﹣1 NaOH溶液中逐滴加入a mL 0.2 mol·L﹣1 CH3COOH溶液,有关混合溶液的判断正确的是 ( )
A.当pH=7时,一定有:c(Na+)=c(CH3COO﹣)=c(OH﹣)=c(H+)
B.当a=25时,一定有:c(CH3COO﹣)+c(CH3COOH)=c(Na+)
C.当c(CH3COO﹣)>c(Na+)时,a一定大于12.5
D.当c(OH﹣)>c(H+)时,a一定小于12.5
题目信息应用,根据题目要求答题
5.下列说法正确的是 ( )
A.浓度均为0.1 mol·L-1的醋酸和CH3COONa溶液等体积混合,溶液中有下列关系:
c(CH3COOH) + 2c(H+) =c(CH3COO-)+ 2c(OH-)
B.25 ℃时,将20 mL 0.1 mol·L-1 H2SO4溶液和30 mL 0.15 mol·L-1 NaOH溶液混合,若混合后溶液体积不变,则混合溶液的pH为11
C.将10 mL 0.1 mol·L-1 KAl(SO4)2溶液和10 mL 0.2 mol·L-1Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1:2
D.镁与极稀硝酸反应生成硝酸铵的离子方程式为:
4Mg + 6H+ + NO3-= 4Mg 2+ + NH4+ + 3H2O
4.100 mL 0.1 mol / L的盐酸与50 mL 0.2 mol / L的氨水混合,充分反应后,所得溶液中各种离子浓度关系正确的是 ( )
A.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.c(Cl-)=c(NH4+ )>c(OH-)=c(H+)
C.c(H+)+c(NH4+ )=c(Cl-) +c(OH-) D.c(H+)+c(Cl-)=c(NH4+)+c(NH3·H2O)+c(OH-)
3.有4种混合溶液,分别由等体积0.1 mol/L的2种溶液混合而成:
①CH3COONa与Na2CO3;②CH3COONa与NaCl;③CH3COONa与NaOH;④CH3COONa与HCl。
c(CH3COO一)排序正确的是 ( )
A.③>①>②>④ B.③>②>①>④
C.④>②>①>③ D.④>②>③>①
2.含有1 mol FeBr2的溶液中,通入1 mol Cl2。已知Fe2+能和Br2反应生成Fe3+,溶液内发生反应的离子方程式为 。
1.下列反应的离子方程式正确的是 ( )
A.硫酸镁溶液跟氢氧化钡溶液反应: +Ba2+=BaSO4↓
+Ba2+=BaSO4↓
B.稀硫酸滴在铜片上: Cu+2H+=Cu2++H2↑
C.FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D.食醋除水垢中的碳酸钙:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
4.已知1molSO2(g)被O2(g)氧化为1molSO3(g)的 H=-99kJ·mol-1。请在下面的坐标图中画出2SO2(g)+O2(g)
H=-99kJ·mol-1。请在下面的坐标图中画出2SO2(g)+O2(g)  2SO3(g)的反应过程和能量变化图。
2SO3(g)的反应过程和能量变化图。
电解质溶液
3.已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+  ΔH=-226
kJ/mol
ΔH=-226
kJ/mol
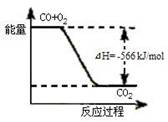
以上热化学方程式判断,下列说法正确的是 (
.CO的燃烧热为283 kJ
.右图可表示由CO生成CO2的反应过程和能量关系
.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com