
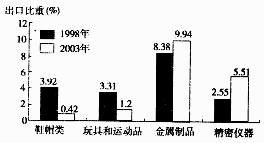
7.台湾部分产品出口比重上升,反映其工业转向为
A.廉价劳动力指向型 B.市场指向型 C.技术指向型 D.动力指向型
煤炭液化技术是把固体煤炭通过化学加工过程,使其转化成为液体燃料、化工原料和产品的先进洁净煤技术。结合所学知识回答8-9题。
6.台湾部分产品出口比重下降,其丧失的竞争优势
主要是
A.广阔的市场 B.低廉的劳动力
C.先进的技术 D.通达的信息
5.下列关于海水密度分布及其影响的说法,正确的是
A.表层海水密度的分布规律是从赤道向两极地区递减
B.海水密度的垂直分布规律是从表层向深层逐渐增加
 C.海水最大密度出现在低纬地区的海面
C.海水最大密度出现在低纬地区的海面
D.海水密度与洋流运动无关
读台湾部分出口产品比重示意图,回答6-7题。
4.由图可知,赤道附近的表层海水
A.温度低、盐度高、密度小 B.温度高、盐度高、密度大
C.温度低、盐度低、密度大 D.温度高、盐度低、密度小
3.若AB位于以地球南极为中心的俯视图上的两条日期分界线上,B点为180°,则
A.新旧两天比为1:3 B.A点的经度为0°
C.伦敦此时旗杆影子朝东 D.北京时间为14时
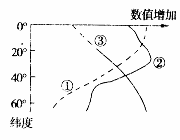 海水密度是指单位体积的海水质量,其大小取决于盐度、水温和压力。读海水温度、盐度、密度随纬度变化图,回答4-5题。
海水密度是指单位体积的海水质量,其大小取决于盐度、水温和压力。读海水温度、盐度、密度随纬度变化图,回答4-5题。
2.若AB线位于75°N纬线上,6月22日晨昏线与A点的距离最
近时,下列说法正确的是
A.该日B点太阳从地平线上升起 B.A点的地方时为12时
C.A点的太阳高度为8.5° D.B点的正午太阳高度是46.5°
1.若AB线位于同一经线圈,2010年元旦时,A为太阳直射点,则
A.A、B的纬度值互余 B.A、B纬度值相等
C.B正值极夜现象 D.A、B在同一经线上
(二)选考题:(共15分,请考生从给出的3道试题中任选一题做答。如果多做,则按所做的第一题计分。)
27.[ 化学──选修化学与技术](15分)
我国有较长的海岸线,浩瀚的海洋是一个巨大的物质资源和能量的宝库。目前世界各国都在研究如何充分利用海洋资源。
 ⑴如右图所示,在电场中利用膜技术(阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)淡化海水,该方法称为电渗析法。
⑴如右图所示,在电场中利用膜技术(阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)淡化海水,该方法称为电渗析法。
①图中膜a应选用 膜。
②电渗析法还可用来处理电镀废液,写出用该方法处理含硫酸铜废液时(使用惰性电极)所发生的电极反应式为 :阴极 ;阳极 。
⑵海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg·L-1。其工业提取法有:
ⅰ:空气吹出纯碱吸收法。该法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到单质溴。该方法涉及的反应有:
①_________________(写出化学方程式);
②3Br2+3CO32-=BrO3-+5Br-+3CO2↑;
③BrO3-+5Br-+6H+=3Br2+3H2O。
其中反应中③氧化剂是____________,还原剂是___________
ⅱ:溶剂萃取法。该法是利用单质溴在水中和萃取剂中溶解度的不同的原理来进行的。实验室中萃取用到的主要玻璃仪器名称是 ___________。下列可以用于海水中溴的萃取的试剂是 __________。①乙醇,②四氯化碳,③硝酸
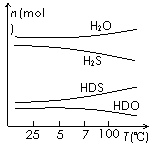 (3)海水中的氘(含HDO 0.03‰)发生聚变的能量,足以保证人类上亿年的能源消费,工业上可采用“硫化氢-水双温交换法”富集HDO。其原理是利用H2S、HDS、H2O和HDO四种物质,在25℃和100℃两种不同的温度下发生的两个不同反应得到较高浓度的HDO。
(3)海水中的氘(含HDO 0.03‰)发生聚变的能量,足以保证人类上亿年的能源消费,工业上可采用“硫化氢-水双温交换法”富集HDO。其原理是利用H2S、HDS、H2O和HDO四种物质,在25℃和100℃两种不同的温度下发生的两个不同反应得到较高浓度的HDO。
右图为“硫化氢-水双温交换法”所发生的两个反应中涉及的四种物质在反应体系中的物质的量随温度的变化曲线。写出100℃时所发生反应的化学方程式 ;工业上富集HDO的生产过程中,可以循环利用的一种物质是 。
30.[ 化学──选修物质结构与性质](15分)
图表法、图象法是常用的科学研究方法。
下表列出前20号元素中的某些元素性质的一些数据:
|
元素 性质 |
A |
B |
C |
D |
E |
F |
G |
H |
I |
J |
|
原子半径(10-10m) |
1.02 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
1.17 |
|
最高价态 |
+6 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
+4 |
|
最低价态 |
-2 |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-4 |
试回答下列问题:
(1)以上10种元素中第一电离能最小的是: (填编号)。比元素B原子序数大10的元素在元素周期表中的位置: 周期, 族,其基态原子的核外电子排布是 。
(2)由上述C、E、G三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是 (写分子式,写出两种即可),元素G、I分别和J形成的两种化合物的晶体类型分别是 。
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其E分子中共形成 个σ键, 个π键。
(4) 短周期某主族元素K的电离能情况如图(A)所示。
则K元素位于周期表的第
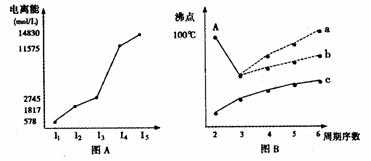 族。
族。
图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。
不同同学对某主族元素的氢化物的沸点的变化趋势画出了两条折线-折线a和折线b,你认为正确的是 ,理由是
。
31、[ 化学──选修有机化学基础](15分)
目前,化学农药已进入一个超高效、低毒化、无污染的新时期。一种高效、低毒农药“杀灭菊酯”的合成路线如下:
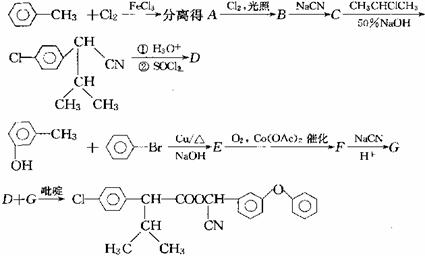
已知:
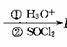 R-CH2-CN
R-CH2-CO-Cl
;F能发生银镜反应。回答问题:
R-CH2-CN
R-CH2-CO-Cl
;F能发生银镜反应。回答问题:
(1)写出A、C的结构简式:A ; C 。
(2)下列变化的反应类型是:B→ C ;E → F
。
(3)写出下列变化的化学方程式:
C → 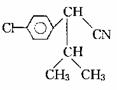
;
E→F
。
D+G
。
(4)解决有机分子结构问题的最好的手段是核磁共振氢谱(PMR)。有机化合物分子中有几种化学环境不同的氢原子,在PMR中就有几个不同的吸收峰,吸收峰的面积与H原子数目成正比。在核磁共振氢谱中A物质会出现 组峰,其吸收峰的面积之比为
(5)写出分子中有两个苯环,还能与NaHCO3 反应放出气体且与F互为的同分异构体的有机物的结构简式: 。
(一)必考题(共5题,共44分)
24、

 (7分)水是生命之源,也是化学反应中的主角。试回答下列问题:
(7分)水是生命之源,也是化学反应中的主角。试回答下列问题:
 (1)写出水的电子式
。
(1)写出水的电子式
。
 (2)A、B、C是中学化学常见的三种有色物质(其组成的元素均属短周期元素),摩尔质量依次增大,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,请写出A、B、C与水反应的化学方程式:
(2)A、B、C是中学化学常见的三种有色物质(其组成的元素均属短周期元素),摩尔质量依次增大,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,请写出A、B、C与水反应的化学方程式:
 A+H2O ;
A+H2O ;
 B+H2O ;
B+H2O ;
 C+H2O 。
C+H2O 。
25. (6分)A、B、C、D是常见的不同主族的短周期元素,它们的原子序数逐渐增大,其中只有一种是金属元素,D元素原子最外层电子数是C元素原子最外层电子数的二倍,B元素原子的最外层电子数比D的最外层电子数少两个。E也是短周期元素,与D同主族。
(6分)A、B、C、D是常见的不同主族的短周期元素,它们的原子序数逐渐增大,其中只有一种是金属元素,D元素原子最外层电子数是C元素原子最外层电子数的二倍,B元素原子的最外层电子数比D的最外层电子数少两个。E也是短周期元素,与D同主族。
 (1)写出B的元素符号 B , 画出E的原子结构示意图
。
(1)写出B的元素符号 B , 画出E的原子结构示意图
。
 (2)由上述五种元素中的三种组成的易溶于水的物质中,能促进水电离的物质M的化学式是 其原因用离子方程式表示为
。能抑制水电离的物质N的名称是 (写出一种物质即可)。
(2)由上述五种元素中的三种组成的易溶于水的物质中,能促进水电离的物质M的化学式是 其原因用离子方程式表示为
。能抑制水电离的物质N的名称是 (写出一种物质即可)。
26. (8分)某溶液中可能含有CO32-、SO42-、HCO3-三种离子中的一种、两种或三种都有。为探究其组成,现取出两份相同的样品溶液于试管中,向一份中加入过量的盐酸,产生无色气泡;向另一份中滴加过量的氢氧化钡溶液,产生白色沉淀。请设计合理实验,在此实验的基础上做进一步的实验,得出实验结论。
(8分)某溶液中可能含有CO32-、SO42-、HCO3-三种离子中的一种、两种或三种都有。为探究其组成,现取出两份相同的样品溶液于试管中,向一份中加入过量的盐酸,产生无色气泡;向另一份中滴加过量的氢氧化钡溶液,产生白色沉淀。请设计合理实验,在此实验的基础上做进一步的实验,得出实验结论。
 仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、集气瓶、铁架台、漏斗、滤纸、酒精灯;1mol/L硫酸、;2mol/L盐酸;2mol/L硝酸、;1mol/L氯化钡、1mol/L氢氧化钡、澄清石灰水、蒸馏水。
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、集气瓶、铁架台、漏斗、滤纸、酒精灯;1mol/L硫酸、;2mol/L盐酸;2mol/L硝酸、;1mol/L氯化钡、1mol/L氢氧化钡、澄清石灰水、蒸馏水。
 完成下列探究过程:
完成下列探究过程:
 (1)提出假设:
(1)提出假设:
 假设1:溶液中只存在CO32-
假设1:溶液中只存在CO32-
 假设2:
。
假设2:
。
 假设3:
。
假设3:
。
 假设4:
。
假设4:
。
 假设5:
。
假设5:
。
 假设6:溶液中存在CO32-、SO42-、HCO3-。
假设6:溶液中存在CO32-、SO42-、HCO3-。
 (2)基于假设6,设计出实验方案,将实验操作、预期的实验现象和结论填在下表中。
(2)基于假设6,设计出实验方案,将实验操作、预期的实验现象和结论填在下表中。
 (可不填满,也可增加步骤)
(可不填满,也可增加步骤)
|
步骤编号 |
实验步骤及预期现象和结论 |
|
① |
|
|
② |
|
|
③ |
|
|
④ |
|
27(13分)、氨是重要的化工原料,合成氨是哈伯1905年发明的。2001年希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池中,H2和N2在电极上合成氨。此法的转化率大为提高。已知:
 N2 (g)+ 3H2
(g)
2NH3(g) △H < 0 。请回答下列问题:
N2 (g)+ 3H2
(g)
2NH3(g) △H < 0 。请回答下列问题:
(1)电解法合成氨可以使用水做电解液吗? ,为什么?
。
(2)若合成氨反应容器的容积为2 L,开始充入3mol H2和1mol N2 反应达到平衡时气体的压强变为原来的 7/8 ,则氮气的转化率为 。
该反应的化学平衡常数的表达式为 ,升高温度,平衡常数将 。 (填增大、减少或不变);增大反应容器的体积,再达到平衡时,混合气的平均分子量将
。(填增大、减少或不变)。
 (3)在一定条件下氨可与其他物质反应生成尿素(CO(NH2)2
),已知30 g尿素在高温高压下分解生成11.2 LNH3(标况)、5.6 LCO2和一定量的三聚氰胺分子(三聚氰胺的相对分子质量为126)。不法分子曾在低蛋白含量的奶粉中加入三聚氰胺来提高奶粉中的蛋白质含量,导致许多婴幼儿肾结石。写出三聚氰胺的分子式为
,其化学反应方程式为 。 三聚氰胺分子中有一个六元环,一个三聚氰胺分子可分解生成三个分子A,则A的结构式是
。
(3)在一定条件下氨可与其他物质反应生成尿素(CO(NH2)2
),已知30 g尿素在高温高压下分解生成11.2 LNH3(标况)、5.6 LCO2和一定量的三聚氰胺分子(三聚氰胺的相对分子质量为126)。不法分子曾在低蛋白含量的奶粉中加入三聚氰胺来提高奶粉中的蛋白质含量,导致许多婴幼儿肾结石。写出三聚氰胺的分子式为
,其化学反应方程式为 。 三聚氰胺分子中有一个六元环,一个三聚氰胺分子可分解生成三个分子A,则A的结构式是
。
28、(10分)A、B、C、D、E是中学化学常见的单质,其中只有A、C是常温下为气态的单质。E的摩尔质量是A的2倍,F、G、H、I、J 5种化合物分别由上述五种元素中的两种组成。D与F反应放出大量的热。它们之间的转化关系如下图所示(反应条件已省略):
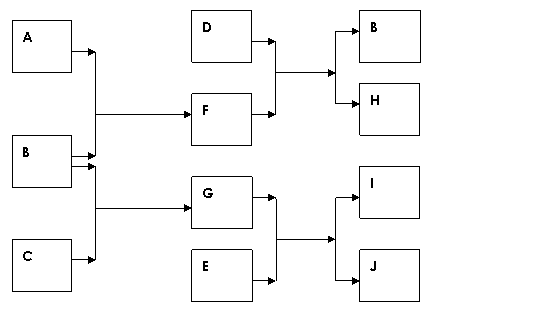

请回答下列问题:
(1) 元素B在周期表的位置是:周期 ,族 。
(2) 写出D与F 反应的化学方程式
。该反应在工业生产中的用途是 (至少写出一点)。
已知 H能与烧碱溶液反应,写出与烧碱溶液反应的离子方程式
。
(3) 若J中含有B元素,写出检验化合物J中阳离子的有关离子方程式:
。

23.已知下列热化学方程式:
Zn (s)+ 1/2 O2 (g)=ZnO(s) △H = -351.1kJ/mol
Hg(l)+ 1/2 O2 (g)=HgO(s) △H = -90.7kJ/mol
由此可知热化学方程Zn (s)+ HgO(s)=ZnO(s)+Hg(l) 的反应热△H为
A.-260.4kJ/mol B.-254.6kJ/mol
C.-438.9kJ/mol D.-441.8kJ/mol
第Ⅱ卷 (非选择题, 59分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com