
17.(14分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①、碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2-3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
②、将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③、向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂恰好变色,且半分钟不变化,测得所耗盐酸的体积为V1mL;
 ④、重复以上过程,但滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
④、重复以上过程,但滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
(1)锥形瓶中的溶液从__________色变为_________色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应注视________________________; 
(3)该小组在步骤①中操作的错误之处是_________________________,由此造成的测定结果___________(填偏高、偏低或无影响);
(4)步骤②缺少的操作是________________________________________;
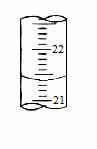
(5)如图,是某次滴定时的滴定管中的液面,其读数为______mL;
(6)根据下列数据:
|
滴定次数 |
待测液体(mL) |
标准盐酸体积(mL) |
|
|
滴定前读(mL) |
滴定后读数(mL) |
||
|
第一次 |
25.00 |
0.50 |
20.40 |
|
第二次 |
25.00 |
4.00 |
24.10 |
请计算待测烧碱溶液的浓度为___________ mol/L
16.(8分) Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
 ①Z的原子序数为24,其余的均为短周期主族元素;
①Z的原子序数为24,其余的均为短周期主族元素;
 ②Y原子价电子(外围电子)排布msnmpn;
②Y原子价电子(外围电子)排布msnmpn;
 ③R原子核外L层电子数为奇数;
③R原子核外L层电子数为奇数;
 ④Q、X原子p轨道的电子数分别为2和4。
④Q、X原子p轨道的电子数分别为2和4。
 请回答下列问题:
请回答下列问题:
 (1)X元素原子的外围电子的轨道表示式是 。
(1)X元素原子的外围电子的轨道表示式是 。
(2)Z元素原子的核外电子排布式是 。
 (
( 3)Q与Y形成的最简单气态氢化物分别为甲、乙,稳定性比较甲
乙(>或<)。
3)Q与Y形成的最简单气态氢化物分别为甲、乙,稳定性比较甲
乙(>或<)。
 (4)Q、R、Y第一电离能数值由小到大的顺序为
(用元素符号作答)。
(4)Q、R、Y第一电离能数值由小到大的顺序为
(用元素符号作答)。
15.(10分)按要求填写下列空白。
(1)工业上可以用FeS处理含Hg2+废水,简述其原因 ,用这种方法处理废水时产生的Fe2+,经氧化后还可以对水起到净化作用,请用相关的离子方程式解释净水的原因 。
(2)将硫化钠溶液与氯化铝溶液混合,没有硫化铝生成,却有氢氧化铝沉淀析出并同时放出硫化氢气体,写出有关反应的离子方程式 。
(3)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl或MgO,请写出相应反应的化学方程式(任写一个即可) ,用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O,能得到无水氯化镁,其原因是 。
14.T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论正确的是( )
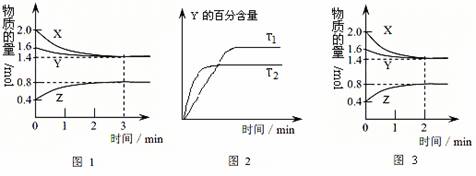
A.容器中发生的反应可表示为:3X(g)+Y(g)  2Z(g)
2Z(g)
B.反应进行的前3 min内,用X表示的反应速率 v(X)=0.3mol/(L·min)
C.保持其他条件不变,升高温度,反应的化学平衡常数K会增大
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
第II卷(非选择题 共64分)
13.已知常温下:Ksp[Mg(OH)2]=1.2×10-11;Ksp(AgCl)=1.8×10-10;Ksp(Ag2CrO4)=1.9×10-12;Ksp(CH3COOAg)=2.3×10-3。下列叙述正确的是(均在常温下操作)
A.等体积混合浓度均为0.2 mol•L-1的AgNO3溶液和CH3COONa溶液一定产生CH3COOAg沉淀
B.将0.001 mol•L-1的AgNO3溶液滴入浓度均为0.001 mol•L-1的KCl和K2CrO4溶液中先产生Ag2CrO4沉淀
C.在Mg2+浓度为0.12 mol•L-1的溶液中,要产生Mg(OH)2沉淀,溶液的pH至少要控制在9以上
D.向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)变大
12.下列各溶液中,粒子的物质的量浓度关系正确的是( )
A.0.1mol/L的Ba(NO3)2溶液中: c(Ba+)=2c(NO3-)>c(H+)= c(OH-)
B.0.1mol/L的NaHSO3溶液(pH < 7)中:c(SO32-) <c(H2SO)
C.在25℃时,0.1mol/L的NaCN溶液中:c (CN-)+ c(HCN)=0.1mol/L
D.明矾[KAl(SO4)2]溶液中:c (K+) >c (Al3+) >c (OH-) >c (H+)
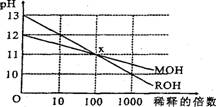
11.MOH和ROH两种一元碱的溶液分别加水稀释时,
pH变化如右图所示。下列叙述中正确的是 ( )
A.MOH和ROH都是强碱
B.在x点,c(M+)=c(R+)
c.稀释前,c (ROH)=10 c (MOH)
D.常温下pH之和为l4的醋酸和ROH溶液等体积混合,所得溶液呈碱性
9.下列各组离子,一定能在指定环境中大量共存的是( )
A.在由水电离出的c(H+)=10-12 mol·L-1的溶液中:Na+、Ba2+、HCO3¯、Br¯
B.含有0.1mol/LHCO3-的溶液:Na+、Al3+、NO3-、Cl¯
C.pH=13的溶液中:Na+、CO32-、K+、AlO2-
D.在25℃时, 的溶液中:NH4+、K+、Cl¯、SO32-
的溶液中:NH4+、K+、Cl¯、SO32-
10.把6molA气体和5molB气体混合放在4L密闭容器中,在一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1 mol/(L·min),下列说法错误的是( )
2C(g)+xD(g),经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1 mol/(L·min),下列说法错误的是( )
A.x = 2
B.恒温达到平衡时容器内压强为开始时的85%
C.B的转化率为20%
 D.平衡时A的浓度为0.8mol/L
D.平衡时A的浓度为0.8mol/L
8.将固体NH4I置于密闭容器中,在某温度下,发生下列反应:NH4I(s) NH3(g)+
HI(g),2HI(g)
NH3(g)+
HI(g),2HI(g) H2(g)+
I2(g),当达化学平衡时,c(H2)= 0.5 mol/L,c(HI)= 4 mol/L,则容器中NH3 、HI、I2的物质的量比是( )
H2(g)+
I2(g),当达化学平衡时,c(H2)= 0.5 mol/L,c(HI)= 4 mol/L,则容器中NH3 、HI、I2的物质的量比是( )
A.8 :8 :1 B.10 :8 :1
C.2 :2 :1 D.3 :2 :1
7.已知化学反应:2A(?)+B(g) 2C(?)达到平衡,当增大压强时,平衡向逆反应方向移动,则下列情况可能的是( )
2C(?)达到平衡,当增大压强时,平衡向逆反应方向移动,则下列情况可能的是( )
A.A是气体,C是固体 B.A、C均为气体
C.A、C均为固体 D.A是固体,C是气体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com