
11.对于相同温度时三种溶液:a.盐酸 b.醋酸 c.氯化铵溶液。下列说法正确的是
A.相同浓度的三种溶液,溶液中的c(H+)相同
B.相同浓度的三种溶液中水的电离度:c>b>a
C.pH相同的三种溶液完全反应消耗的氢氧化钠的物质的量:c>b>a
D.同浓度、同体积三种溶液与一定量NaOH恰好反应后,阴离子浓度相同
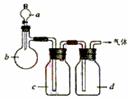
10.拟用右图装置制取表中的四种干燥、纯净
的气体(图中铁架台、铁夹及气体收集装置均已
略去)。a、b、c、d表示相应仪器中加入的试剂
正确的是( )。
|
|
气体 |
a |
b |
c |
d |
|
A |
C2H2 |
饱和氯化钠溶液 |
电石 |
溴水溶液 |
浓H2SO4 |
|
B |
Cl2 |
浓盐酸 |
MnO2 |
NaOH溶液 |
浓H2SO4 |
|
C |
NH3 |
饱和NH4Cl溶液 |
消石灰 |
H2O |
固体NaOH |
|
D |
CO2 |
稀HNO3 |
大理石 |
饱和NaHCO3溶液 |
浓H2SO4 |
9.下列叙述正确的是( )。
A.合成氨生产中将NH3液化分离,可加快正反应速率,提高H2的转化率
B.硫酸工业中,接触室中热交换器是利用SO3转化为H2SO4时放出的热量
C.氯碱工业采用离子交换膜法,可防止阳极室产生的Cl2进入阴极室
 D.钢铁发生吸氧腐蚀时,阴极的反应式为:Fe-2e→Fe2+
D.钢铁发生吸氧腐蚀时,阴极的反应式为:Fe-2e→Fe2+
8.某溶液中可能含有Br-、NH4+、Cu2+、SO32-,向该溶液中加入少量氯水,溶液仍呈无色,则下列关于该溶液组成的判断正确的是( )。
①肯定不含Br-; ②肯定不含Cu2+; ③肯定含有SO32-; ④可能含有Br-
A.①③ B.①②③ C.①② D.②③④
7.设NA为阿伏加德罗常数,下列说法正确的是( )。
A.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移电子数为NA
B.7.8 g Na2O2含有阴离子数目为0.2NA[来源:Z。X。X。K]
C.1L0.5mol/L的(NH4)2SO4溶液中含有NA个NH4+
D.58.5g氯化钠中约含有6.02×1023个氯化钠分子
6.下列变化不能说明发生了化学变化的是( )。
A.变化时有电子的得失或共用电子对的形成
B.变化过程中有旧化学键的断裂和新化学键形成
C.变化时释放出能量
D.变化前后原子的种类和数目没有改变,分子种类增加了
5.有机物的种类繁多,下列有机物命名正确的是( )。
A.CH3CH(OH)CH3 丙醇 B.CH2=CHCH2CH3 1-丁烯
C.CH3CCl2CH3 2-二氯丙烷 D.CH3CH(CH2CH3)CH3 2-乙基丙烷
4.光导纤维被认为是20世纪最伟大的发明之一, 2009年诺贝尔物理学奖授予被誉为“光纤之父”的华人科学家高锟。组成光导纤维主要成分SiO2是( )。
A.分子晶体 B.原子晶体 C.离子晶体 D.金属晶体
3.在通常条件下,下列各组物质的性质排列正确的是( )。
A.熔点: KCl>SiO2> SO2
B.结合质子能力:CH3COO->OH->Cl-
C.沸点:正戊烷>异戊烷>新戊烷
D.稳定性:H2S>H2O>PH3
2.以下表示锂离子结构的轨道表示式是( )。
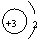 A.Li+
B.
C.1s2 D.
A.Li+
B.
C.1s2 D. 
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com