
11. 在一接近中性的含Na+的溶液中,可能还存在NH4+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的某几种。进行以下实验:①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;②向呈橙黄色溶液中加入BaCl2溶液时无沉淀生成;③橙黄色溶液不能使淀粉变蓝。由此可以推知该溶液中肯定不存在的离子是( )
A. NH4+、Br-、CO32- B. NH4+、I-、SO32-
C. Fe2+、I-、SO32- D. Fe2+、CO32-、I-
10.实验是化学研究的基础,关于下列各实验装置的叙述中,正确的是
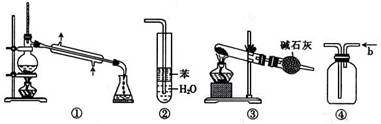
A.装置①常用于分离互不相溶液体混合物
B.装置②可用于吸收HCl气体,并防止倒吸
C.以NH4HCO3为原料,装置③可用于实验室制备少量NH3
D.装置④b口进气可收集CO2、NO等气体
9.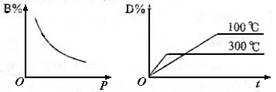 在一密闭容器里进行下列反应A(g)+B(g)
在一密闭容器里进行下列反应A(g)+B(g)  2C+D(g)此反应符合下列两个图象,则此反应符
2C+D(g)此反应符合下列两个图象,则此反应符
A.正反应为吸热反应,C是固体
B.正反应为吸热反应,C是气体
C.正反应为放热反应,C是气体
D.正反应为放热反应,C是固体或液体
8. F2和Xe在一定条件下可生成氧化性极强且极易水解的XeF2、XeF4和XeF6三种化合物。如XeF4与水可发生如下反应:6XeF4+12H2O==2XeO3+4Xe↑+24HF+3O2↑。下列判断中正确的是
A.XeF2分子中各原子均达到八电子结构
B.上述反应中只有XeO3分子为氧化产物
C.上述反应中氧化剂和还原剂的物质的量之比为1∶2
D.XeF4按已知方式水解,每生成4molXe,转移12mol电子
7. 下列有关叙述中,正确的是
A. 氧元素的相对原子质量为16.00,故氧原子核内的质子数和中子数均是8
B. 等物质的量的CH5+离子和NH4+离子中所含有的质子数相等
C. 白磷分子的摩尔质量为31
D. NaOH中既含有离子键又含有非极性键
6. 下列有关环境污染的说法不正确的是( )
A.在采矿厂、制陶厂、耐火材料厂等场所长期工作人员若不采取劳动保护措施,则容易患上硅肺病
B.氮的氧化物可以造成光化学污染,也可以破坏臭氧层,同时还可以形成酸雨
C.工业废水、生活污水、农药、化肥、含磷洗涤剂等都可以对水体造成污染
D.植树造林既能缓解温室效应,又能降低酸雨的危害
30、(16分)下列是芳香族化合物A、B、C、D、E的转化关系,其中A、E分子式分别是C9H8O和C9H8O2,E分子中除苯环外还含有一个六元环,且E中不含甲基。根据下列转化关系回答问题:
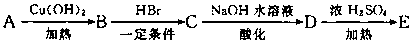
(1)写出A分子中所含官能团的名称____________。
(2)完成方程式,并写出反应类型:
A→B________________________,反应类型________________________。
B→C________________________,反应类型________________________。
(3)写出E的结构简式____________;写出由D反应生成高聚物的结构简式___________。
(4)D的同分异构体符合下列条件:①苯环有两个取代基;②取代基上无甲基;③能与FeCl3溶液发生显色反应;④能发生水解反应和银镜反应。
写出其中任意一种同分异构体的结构简式________________________。
29、(14分)某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
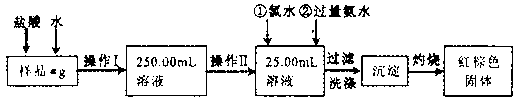
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒、量筒外,还必须有____________ (填自选仪器名称),操作II必须用到的仪器是____________(填编号)。
A.50mL烧杯 B.50mL量筒
C.25mL碱式滴定管 D.25mL酸式滴定管
(2)洗涤是洗去附着在沉淀上的____________。(写离子符号)
(3)检验沉淀是否已经洗涤干净的操作是________________________。
(4)将沉淀物加热,并置于干燥器中冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是____________。
(5)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是____________。
(6)有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的。他的理由是________________________。(用化学方程式表示)
28、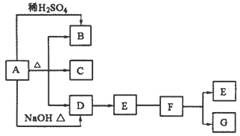 (15分)下列A-G均是中学常见化合物,它们之间有如图的转化关系(部分反应物或生成物略去),已知B为一种气体,E、F、G三种化合物中均含有同一种元素M,且价态互不相同。请回答下列问题。
(15分)下列A-G均是中学常见化合物,它们之间有如图的转化关系(部分反应物或生成物略去),已知B为一种气体,E、F、G三种化合物中均含有同一种元素M,且价态互不相同。请回答下列问题。
(1)M元素为____________。
(2)B是____________或____________,写出两种鉴别它们的方法____________;____________。
(3)若A与G反应也能制B,且反应中n(A)︰n(G)=1︰2,则此时该反应的离子方程式是________________________。
(4)若B与F在一定条件下反应生成一种化合物和一种单质,该反应的化学方程式为________________________。
27、(15分)X、Y、Z、W是原子序数依次增大的短周期元素,互不同族,其中只有两种为金属元素;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。Y和W的单质都能与NaOH溶液反应。请回答下列问题:
(1)X元素的名称是_______,Y、Z、W的原子半径由小到大的顺序是____________(用元素符号表示)。
(2)W元素在周期表中的位置是_________,Y元素的原子结构示意图是____________。
(3)Z和W在一定条件下能形成化合物ZW2,分子中各原子均达到了8电子稳定结构,则ZW2的电子式是____________;它在常温下呈液态,形成晶体时,属于____________晶体。
(4)X的单质与Y的单质化学性质相似,则X的单质与NaOH溶液反应的离子方程式是____________________(注:生成物中,含有X元素的化合物的化学式中含有2个氧原子)
(5)0.1mol W的单质与50 mL 1.5 mol¡L-1的FeBr2溶液反应,被氧化的Fe2+和Br-的物质的量之比是____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com