
3.金属的防护
(1)制成合金以改变金属的内部结构,如不锈钢。
(2)金属表面覆盖保护层:如电镀、喷油漆。
(3)电化学保护法:利用原电池原理,可将比被保护金属更活泼的金属焊在被保护金属表面,形成原电池时,更活泼金属被腐蚀。
2.电化学腐蚀:
例:钢铁的电化腐蚀。
|
类型 |
析氢腐蚀 |
吸氧腐蚀 |
|
形成条件 |
水膜酸性较强 |
水膜酸性很弱或呈中性 |
|
电解质溶液 |
溶有CO2的水溶液 |
溶有O2的水溶液 |
|
负极 |
Fe |
|
|
负极反应 |
Fe-2e-=Fe2+ |
|
|
正极 |
C |
|
|
正极反应 |
2H++2e-=H2↑ |
2H2O+O2+4e-=4OH- |
|
电子如何流动形成电通路 |
Fe失电子成为Fe2+ 进入溶液,Fe失去的电子流入C极,H+ 趋向于C极与C极上的电子结合成H2析出溶液 |
Fe失电子成为Fe2+进入溶液,Fe失去的电子流入C极,O2在C极获得电子成为OH-进入溶液 |
|
最终腐蚀产物 |
铁锈(Fe2O3的复杂水合物) |
|
|
普遍性 |
吸氧腐蚀比析氢腐蚀更普遍 |
1.金属的腐蚀:
⑴化学腐蚀:金属或合金跟接触到的物质直接发生氧化还原反应而消耗的过程。
⑵电化学腐蚀:不纯金属或合金与电解质溶液接触发生原电池反应而消耗的过程。
|
|
化学腐蚀 |
电化学腐蚀 |
|
条件 |
金属与非电解质直接接触(不与电 解质溶液接触) |
不纯金属或合金跟电解质溶液接触 |
|
现象 |
无电流产生(不发生原电池反应) |
有电流产生(发生原电池反应) |
|
本质 |
发生氧化--还原反应,金属被腐 蚀 |
氧化反应和还原反应分两极进行,较活泼的金属被腐蚀 |
|
相互关系 |
两种腐蚀往往同时发生,但电化学腐蚀更普遍 |
1.几种常见的电池:
(1)锌-锰干电池(一次电池):
锌为干电池的负极,碳棒为正极。以NH4Cl、ZnCl2、MnO2呈糊状液为电解质溶液。电极反应式:
负极(锌筒):Zn-2e-=Zn2+
正极(石墨):
2NH4++2e-=2NH3↑+ H2↑
2NH4++2MnO2+ 2e-=2NH3↑+Mn2O3+H2O
总反应:Zn+2NH4+=Zn2++2NH3↑+H2↑
Zn+2NH4++2MnO2= Zn2++2NH3↑+Mn2O3+H2O
(2)铅蓄电池 :
Pb为负极,PbO2为正极,30%的H2SO4溶液为电解质溶液。
负极Pb:Pb+SO42--2e-= PbSO4
正极PbO2:PbO2+4H++SO42-+2e-=PbSO4+2H2O
总反应:Pb+PbO2+2H2SO4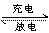 2PbSO4+2H2O
2PbSO4+2H2O
汽车用电池大多用铅蓄电池
(3)燃料电池:氢氧燃料电池是一种新型的化学电池,其构造为:两个电极均由多孔性碳制成,通入的气体由孔隙逸出,并在电极表面放电。(一般以KOH为电解质溶液)
负极H2:2H2+4OH――4e-=4H2O
正极O2:O2+2H2O+4e-=4OH-
总反应: O2+2H2=2H2O
(4)高能电池─锌银电池:不锈钢制成一个由正极壳和负极盖组成的小圆盒,盒内靠正极一端填充由Ag2O和少量石墨组成的正极活性材料,负极盖一端填充锌汞合金做负极活性材料,电解质溶液为浓KOH溶液,已知电池内Zn的氧化产物为ZnO,
如:银-锌电池
负极:Zn+2OH――2e-=ZnO+H2O
正极:Ag2O+H2O+2e-=2Ag+2OH-
总反应: Ag2O+Zn=ZnO+2Ag
考点三、金属的腐蚀与防护
6.原电池原理的应用:
(1)设计化学电源:根据氧化还原反应的特点,将其拆成两个半反应:氧化反应和还原反应,分别作为原电池的负极反应式和正极反应式;若发生氧化反应的物质为金属单质,则用该金属作为负极材料,若为气体或溶液中的某种离子,则用惰性材料做负极;而作为正极的材料必须不如负极活泼,或为惰性电极;电解质溶液选择反应中的电解质即可,若与电解质无关,则需选择一种不能使电极材料消耗的电解质溶液,以增强导电性;
(2)判断反应速率:如在制取氢气的过程中,加入少量铜或硫酸铜可形成锌-铜原电池,使反应速率加快;
(3)判断金属的活泼性:一般情况下,作为负极的金属活泼性较强;如:锌-铜原电池;
(4)金属防护。
考点二、几种常见的电池
5.电极反应:
(1)以铜-锌和稀硫酸组成的原电池为例说明:
电极反应 本质 现象
负极 Zn-2e-=Zn2+ 氧化反应 溶解
正极 2H++2e-=H2↑ 还原反应 气泡
总反应 Zn+2H+= Zn2++H2↑
(2)书写电极反应式一般规律:
①两极电极反应式中的电子得失数目保持相等。
②看负极反应生成的阳离子与电解质溶液中的阴离子能否共存,若不能共存,则该电解质溶液中的阴离子也要写入负极的电极反应式中。如Al-Cu-NaHCO3溶液构成的原电池中,因Al失去电子生成的Al3+能与HCO3-反应:Al3++3HCO3-=Al(OH)3↓+3CO2↑,故铝电极(负极)上发生的反应为:Al-3e-+3HCO3-=Al(OH)3↓+3CO2↑,而不是仅仅写为:Al-3e-=Al3+。
③当正极上的反应物质为O2时(吸氧腐蚀),要注意电解质溶液的性质。溶液为碱性时,电极反应式中不能出现H+;溶液为酸性时,电极反应式中不能出现OH-。
④ 知道总反应式时,可以先分析此反应中的氧化反应或还原反应(即分析有关元素的化合价变化情况),再写出其离子反应方程式;将各反应式看作数学中的代数式,用总反应式减去较易写出一极(一般为负极)的电极反应式,即得另一极的电极反应式。
⑤ 对于可逆电池反应,需要看清楚“充电、放电”的方向,放电过程是体现原电池原理,充电过程是体现电解池原理。
4. 原电池的正负极的判断方法:
(1)金属与金属或金属与导电非金属做电极时,较活泼金属做负极;较不活泼金属做正极。
(2)根据电子的流向判断:电子流出的极为负极,电子流入的极为正极;也可以根据电流方向判断:电流流出极为正极,电流流入极为负极;
(3)根据发生的反应判断:发生氧化反应的极为负极,发生还原反应的极为正极;
(4)根据反应现象判断:一般来说,溶解的一极为负极,有气体或固体析出的一极为正极;
(5)如果给出一个方程式判断电极反应,则化合价升高的电极为负极,化合价降低的电极为正极,由此可设计原电池。
3.工作原理:原电池是利用能发生的氧化还原反应设计而成,较活泼的金属材料作为负极,失去电子,经外电路流向较不活泼金属,再经电解质溶液回到负极,构成闭合回路,电流反向流动。溶液中阴离子向负极移动,阳离子向正极移动。
2.形成条件:
(1)活泼性不同的两电极:一个是较活泼的金属,另一个是较不活泼的金属、石墨(碳棒)或某些金属氧化物(如PbO2)。
(2)电解质溶液
(3)形成闭合回路
1.原电池的定义:把化学能转化为电能的装置叫原电池。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com