
7. X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为( )
A.X>Z>Y>M B.X>Y>Z>M C.M>Z>X>Y D.X>Z>M>Y
解析:金属X和Z用导线连接放入稀H2SO4中,形成原电池,X溶解说明金属活动性X>Z;电解Y2+和Z2+共存的溶液时,Y先析出,则金属活动性Z>Y;离子的氧化性越强,其单质的金属活动性越弱,则金属活动性Y>M,所以正确答案为A。
答案:A
6.钢铁发生电化学腐蚀时,负极发生的反应是( )
A.2H++2e- H2
H2
B.2H2O+O2+4e- 4OH-
4OH-
C.Fe-2e- Fe2+
Fe2+
D.4OH--4e- 2H2O+O2
2H2O+O2
解析:钢铁发生电化学腐蚀时,铁作负极被氧化,电极方程式为:Fe-2e-===Fe2+。
答案:C
5. 随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是( )
随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是( )
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其他物品
D.回收其中的石墨电极
解析:随着生产的发展和人们生活水平的提高,环境污染和环保问题已越来越受到人们重视,废电池中含有汞等多种重金属离子,极易对环境造成污染。
答案:B
4.100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
A.加入适量的3 mol·L-1的盐酸
B.加入数滴氯化铜溶液
C.加入适量蒸馏水
D.加入适量的氯化钠溶液
3.铜片和锌片用导线连接后插入稀硫酸中,锌片是( )
A.阴极 B.正 极 C.阳极 D.负极
解析:电解池的两极分别命名为阴阳极,原电池的两极分别命名为正负极。铜片和锌片用导线连接后插入稀硫酸中形成了原电池,其中锌失电子作原电池的负极。
答案:D
2.家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是( )
A.4Fe(OH)2+2H2O+O2===4Fe(OH)3↓
B.2Fe+2H2O+O2===2Fe(OH)2↓
C.2H2O+O2+4e-===4OH-
D.Fe-3e-===Fe3+
解析:洗过的铁锅在空气中放置,可发生吸氧腐蚀。负极发生的反应为2Fe-4e-==2Fe2+,正极发生的反应为2H2O+O2+4e-===4OH-,总反应式为2Fe+2H2O+O2===2Fe(OH)2,而Fe(OH)2又被O2氧化为红褐色的Fe(OH)3。
答案:D
1.钢铁发生吸氧腐蚀时,正极上发生的电极反应是( )
A.2H++2e-===H2 B.Fe2++2e-===Fe
C.2H2O+O2+4e-===4OH- D.Fe3++e-===Fe2+
解析:钢铁发生吸氧腐蚀,正极上是氧气得电子被还原的反应:2H2O+O2+4e-===4OH-。
答案:C
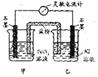
3.氯碱工业
(1)电解饱和食盐水反应原理
①实验步骤
按图装置,在U形管里倒入饱和食盐水,插入一根石墨棒作阳极,一根铁棒作阴极。同时在两边管中各滴入几滴酚酞试液,并用湿润的碘化钾淀粉试纸检验阳极放出的气体。接通直流电源后,注意管内发生的现象。
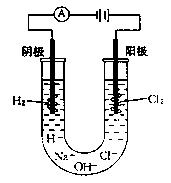
②实验现象
阳极上有气泡逸出,气体呈黄绿色,有刺激性气味,使湿润的碘化钾淀粉试纸变为蓝色,阳极区溶液由无色变为黄绿色。阴极上有气泡逸出,气体无色、无味。阴极区溶液由无色变为浅红色,红色逐渐加深、区域逐渐扩大。
③实验结论
用惰性材料作阳极,电解食盐的饱和溶液,生成Cl2、H2和NaOH。
阳极:2Cl--2e-=Cl2↑(放电顺序:C l->OH-)
l->OH-)
阴极:2H++2e-=H2↑(放电顺序:H+>Na+)
在上述反应中,由于H+在阴极上得到电子而生成H2,破坏了附近的水的电离平衡,促进了水继续电离,结果阴极区溶液里OH-的浓度增大而呈现碱性。
总反应:2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(2)离子交换膜法制烧碱
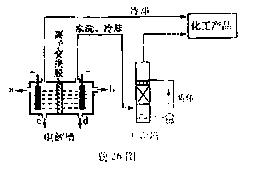
①离子交换膜电解槽的组成
由阳极(金属钛网)、阴极(碳钢网)、离子交换膜、电解槽框和导电铜棒等组成,电解槽由若干个单元槽串联或并联组成。下图表示一个单元槽的示意图。
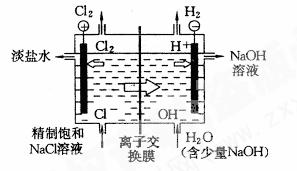
②阳离子交换膜的作用
将电解槽隔成阴极室和阳极室,它只允许阳离子(Na+)通过,而阻止阴离子(Cl-、OH-)和气体通过。这样既能防止阴极产生的H2和阳极产生的Cl2相混合而引起爆炸,又能避免Cl2和NaOH作用生成NaClO而影响烧碱的质量。
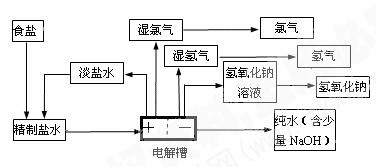
③离子交换膜法电解制烧碱的主要生产流程(如下图)
例1、(2009上海) 右图装置中,U型管内为红墨水
右图装置中,U型管内为红墨水 ,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是
,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是
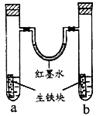
 A.生铁块中的碳是原电池的正极
A.生铁块中的碳是原电池的正极
 B.红墨水柱两边的液面变为左低右高
B.红墨水柱两边的液面变为左低右高
 C.两试管中相同的电极反应式是:
C.两试管中相同的电极反应式是:
 D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
[答案]B
[解析]生铁块在食盐水和氯化铵溶液中均能形成原电池,生铁块中的碳为正极,铁为负极,电极反应式为 ,所以A、C对。其中氯化铵溶液显酸性,发生析氢腐蚀,而食盐水显中性,发生吸氧腐蚀,所以相同条件下,析氢腐蚀的速率币吸氧腐蚀的快,所以红墨水两边液面左高右低,所以B错D对。
,所以A、C对。其中氯化铵溶液显酸性,发生析氢腐蚀,而食盐水显中性,发生吸氧腐蚀,所以相同条件下,析氢腐蚀的速率币吸氧腐蚀的快,所以红墨水两边液面左高右低,所以B错D对。
例2、 Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 = 4LiCl +S +SO2。
请回答下列问题:
(1)电池的负极材料为 ,发生的电极反应为 ;
(2)电池正极发生的电极反应为 ;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 ;
(4)组装该电池必须在无水、无氧的条件下进行,原因是 。
[答案]

[解析]:(1)Li在电池反应中失电子,根据电子流出 的一极是负极,故Li是负极,发生的电极反应式为Li-e-=Li+;(2)SOCl2电池反应中得电子为正极反应物,其电极反应式为
的一极是负极,故Li是负极,发生的电极反应式为Li-e-=Li+;(2)SOCl2电池反应中得电子为正极反应物,其电极反应式为
2 SOCl2+4 e-=4Cl-+S+SO2
(3) SOCl2与水强烈水解生成二氧化硫和HCl,HCl与水形成大量的白雾,故出现白雾同时闻到剌激性气味的气体生成。反应的化学方程式为SOCl2+H2O=2HCl↑+ SO2↑
(4)由于锂是活泼的金属与水、氧等反应,SOCl2能与水反应,所以组装该电池必须在无水、无氧的条件下进行。
例3、(2009广东)10.出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法正确的是
A.锡青铜的熔点比纯铜高
B.在自然环境中,锡青铜中的锡对铜起保护作用
C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快
D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程
[答案]BC
[解析]锡青铜合金具有合金的特性,熔点比任何一种纯金属的低,A错;由于锡的活泼性强于铜,故在形成电化学腐蚀时,锡对铜起到了保护作用,B正确;潮湿的环境更利于金属的电化学腐蚀,C正确;电化学腐蚀过程中涉及电子的转移,又有新物质生成,属于化学反应过程,D错。
例4、(2009福建) 11. 控制适合的条件,将反应
11. 控制适合的条件,将反应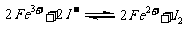
设计成如右图所示的原电池。下列判断不正确的是
 A. 反应开始时,乙中石墨电极上发生氧化反应
A. 反应开始时,乙中石墨电极上发生氧化反应
 B. 反应开始时,甲中石墨电极上Fe3+被还原
B. 反应开始时,甲中石墨电极上Fe3+被还原
 C. 电流计读数为零时,反应达到化学平衡状态
C. 电流计读数为零时,反应达到化学平衡状态
 D. 电流计读数为零后,在甲中溶入FeCl2固定,乙中石墨电极为负极
D. 电流计读数为零后,在甲中溶入FeCl2固定,乙中石墨电极为负极
 例5、(2009浙江)12.市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li
例5、(2009浙江)12.市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li 的高分子材料。这种锂离子电池的电池反应为:
的高分子材料。这种锂离子电池的电池反应为:
Li+2Li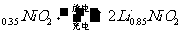
下列说法不正确的是
A.放电时,负极的电极反应式:Li-e =Li
=Li
B.充电时,Li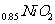 既发生氧化反应又发生还原反应
既发生氧化反应又发生还原反应
C.该电池不能用水溶液作为电解质
D.放电过程中Li 向负极移动
向负极移动
[答案]D
[解析]A项,Li从零价升至正价,失去电子,作为负极,正确;B项,反应逆向进行时。反应物只有一种,故化合价既有升,又有降,所以既发生氧化反应又发生还原反应,正确;C项,由于Li可以与水反应,故应为非水材料,正确;D项,原电池中阳离子应迁移至正极失电子,故错。
例 6、(2009重庆)工业上电解饱和食盐能制取多种化工原料,其中部分原料可用于制备多晶硅。
(1)题26图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是 ;NaOH溶液的出口为 (填字母);精制饱和食盐水的进口为
(填字母);干燥塔中应使用的液体是  。
。
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用收到广泛关注。
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为
 。
。
②SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:
3 SiCl4(g)+2
H2(g)+Si(g)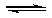 4 SiHCl3(g)
4 SiHCl3(g)
达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为 kg。
(3)采用无膜电解槽电解饱和食盐水,可制取 氯酸钠,同时生成氢气,现制得氯酸钠213.0kg,则生成氢气
氯酸钠,同时生成氢气,现制得氯酸钠213.0kg,则生成氢气
 (标准状况)。
(标准状况)。
[答案]⑴①氯气;a;d;浓硫酸 ⑵①SiCl4+2H2+O2
 SiO2+4HCl
②0.35 ⑶134.4
SiO2+4HCl
②0.35 ⑶134.4
[解析]电解饱和氯化钠溶液时,溶液中的阳离子Na+和H+ 向阴极移动,且氧化性较强的H+首先放电发生还原反应,生成氢气,阴极附近的溶液因消耗氢离子使溶液显碱性,与Na+形成NaOH溶液,阴离子Cl-和OH-向阳极移动,还原性较强的阴离子Cl-首先放电,发生氧化反应生成氯气。
根据方程式可得:H2~2SiHCl3,生成的SiHCl的物质的量浓度为0.020mol/L,所以参加反应的氢气的物质的量浓度为0.01mol。剩余氢气的物质的量为0.14mol/L,则共需要氢气的物质的量浓度为0.15mol/L,物质的量为3mol。由电解饱和NaCl的方程式可知,2NaCl~H2,则消耗NaCl的物质的量为6mol,质量为6mol×58.5g/mol=351g=0.35kg。根据化合价的变化可知,由Cl-生成1molNaClO3失去6mol电子,生成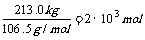 NaClO3转移电子的物质的量为12×103
mol电子,因此生成氢气的物质的量为6×103 mol,在标况下气体体积为134.4m3。
NaClO3转移电子的物质的量为12×103
mol电子,因此生成氢气的物质的量为6×103 mol,在标况下气体体积为134.4m3。
[2010高考预测]纵观历年高考试题可发现,解可充电电池试题的关键在于能否正确书写电极反应式。书写电极反应式的关键是能否正确书写放电时的电极反应式。要正确书写放电时的电极反应式,既要弄清得失电子的物质,还要特别注 意电极产物是否与电解质溶液共存,要写出实际存在的电极反应式。然后根据原电池的负极反应与电解池的阳极反应、原电池的正极反应与电解池的阴极反应互为逆反应,即可快速写出充电时的电极反应式。各电极反应式顺利写出以后,即可正确解题。
意电极产物是否与电解质溶液共存,要写出实际存在的电极反应式。然后根据原电池的负极反应与电解池的阳极反应、原电池的正极反应与电解池的阴极反应互为逆反应,即可快速写出充电时的电极反应式。各电极反应式顺利写出以后,即可正确解题。
测试题
2.电镀
(1)电镀的涵义
电镀是应用电解原理在某些金属表面镀上一薄层其他金属或合金的过程。
(2)电镀的目的
电镀的目的主要是使金属增强抗腐蚀能力、增加美观和表面硬度。
(3)电镀的原理
电镀的原理与电解精炼铜的原理是一致的。电镀时,一般都是用含有镀层金属离子的电解质配成电镀液;把待镀金属制品浸入电镀液中与直流电源的负极相连,作为阴极;用镀层金属作为阳极,与直流电源正极相连。通入低压直流电,阳极金属溶解在溶液中成为阳离子,移向阴极,这些离子在阴极获得电子被还原成金属,覆盖在需要电镀的金属制品上。
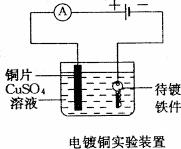
1. 铜的电解精炼
(1)电解法精炼铜的装置(如图)
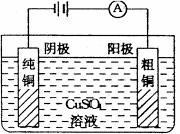
(2)电解法精炼铜的化学原理
阳极(粗铜):Cu-2e-=Cu2+
阴极(纯铜):Cu2++2e-=Cu
说明:
① 以铜为材料做的电极属于活性电极。在一般的电解条件下,活性阳极先于电解质溶液中的成分发生氧化反应。
②粗铜中往往含有锌、铁、镍、银、金等多种杂质,当含杂质的铜在阳极不断溶解时,
位于金属活动性顺序铜以前的金属杂质如Zn、Fe、Ni等,也会同时失去电子,如:
Zn-2e-=Zn2+ ;Ni-2e-=Ni2+
但是它们的阳离子比铜离子难以还原,所以它们并不在阴极获得电子析出,而只是留在电解液里。而位于金属活动性顺序铜之后的银、金等杂质,因为给出电子的能力比铜弱,难以在阳极失去电子变成阳离子溶解下来,当阳极上的铜失去电子变成离子溶解之后,它们以金属单质的形式沉积在电解槽底,形成阳极泥(阳极泥可作为提炼金、银等贵重金属的原料)
③用电解精炼法所得到的铜叫做电解铜,它的纯度可达到99.95%-99.98%。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com