
24、已知A2On2-可与B2-反应,B2-被氧化成B单质,A2On2-被还原成A3+,且知50mL、0.3mol / L的A2On2-溶液与150 mL、0.3mol / L的B2-溶液恰好完全反应,则n值为
A.4 B.5 C.6 D.7
23、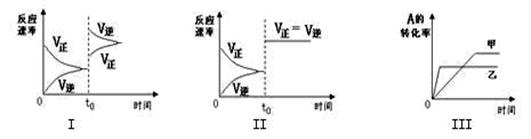
 在容积可变的密闭容器中存在如下反应:2A(g)+2B(g) C(g) +3D(g);△H<0。该可逆反应的反应速率-时间、转化率-时间关系图如下:
在容积可变的密闭容器中存在如下反应:2A(g)+2B(g) C(g) +3D(g);△H<0。该可逆反应的反应速率-时间、转化率-时间关系图如下:
下列分析中不正确的是
A.图I可体现t0时升高温度对反应速率的影响
B.图II可体现t0时增大压强(缩小体积)或使用催化剂对反应速率的影响
C.图III可体现催化剂对化学平衡的影响,且甲使用了催化剂
D.图III可体现温度对化学平衡的影响,且乙的温度较高
22、从下列事实所引出的相应结论,正确的是
|
选项 |
实验事实 |
结论 |
|
A |
等体积pH同为3的酸HA和酸HB与足量Zn反应,酸HA放出氢气多 |
酸性:HA > HB |
|
B |
Na2SO4溶液的pH小于Na2CO3溶液的pH |
非金属性:S > C |
|
C |
电解同浓度的A2+和B2+硝酸盐的混合溶液,A先析出 |
金属性:A > B |
|
D |
由M、N与稀硫酸构成的原电池中,M上产生大量气泡 |
金属性:M > N |
21、关于SnCl4是离子晶体,还是分子晶体,以往曾有过争议。根据你所学的知识,你认为最好通过下列何种实验来确定其晶体类型
A.测其熔点高低 B.测其硬度大小
C.测其水溶性 D.测其熔融物的导电性
20、pH = a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,原溶液的浓度减小,且所得溶液的pH > a ,则该电解质可能是
A.KCl B.H2SO4 C.NaOH D.AgNO3
19、下列变化一定会影响化学平衡的是
A.浓度 B.温度 C.压强 D.催化剂
18、几种短周期元素的原子半径和主要化合价见下表:
|
元素代号 |
X |
Y |
Z |
L |
M |
Q |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.099 |
0.077 |
0.074 |
|
主要化合价 |
十2 |
十3 |
十6,一2 |
十7、一1 |
十4、一4 |
一2 |
下述说法正确的是
A.在化学反应中,M原子既不容易失去电子,又不容易得到电子
B.等物质的量的X、Y的单质与足量盐酸反应,生成H2一样多
C.Y与Q形成的化合物不可能跟氢氧化钠溶液反应
D.Z的氢化物的稳定性强于L的氢化物的稳定性
17、下列实验操作会引起实验结果偏大的是
A.用量筒量取10mL液体时,俯视读数
B.测定中和热的过程中,用铜棒作搅拌棒
C.中和滴定用的酸式滴定管内含有水膜,未经润洗就直接加入标准酸溶液进行滴定
D.测定硫酸铜晶体结晶水含量的实验中,晶体加热完全失去结晶水后,将盛试样的坩埚放在实验桌上冷却
16、在某未知溶液中检验出含有Ba2+、NO3-,且溶液的pH = 1。某学生还需鉴定此溶液中是否大量存在①Al3+ ②NH4+ ③Fe2+ ④Cl- ⑤AlO2- ⑥SO42- 其实这些离子中有一部分不必再鉴定就能加以否定,你认为不必再鉴定的离子组是
A.③⑤⑥ B.④⑤⑥ C.①②⑤ D.①③④
15、下列说法正确的是
A.按Na+、Mg2+、Cl-的顺序离子半径依次减少
B.NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同
C.24Mg 32S晶体中电子总数与中子总数之比为1∶1
D.H2S和SiF4分子中各原子最外层都满足8电子结构
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com