
(原创题)读“上海市连续四周(2008.7.28-2008.8.24)住宅环间均价表(单位:元/平方米)”,回答1-2题。
|
|
内环以内 |
内外环间 |
外环以外 |
|||
|
日期 |
7.28-8.3 |
8.4-8.10 |
7.28-8.3 |
8.4-8.10 |
7.28-8.3 |
8.4-8.10 |
|
住宅均价 |
32 569 |
32 521 |
14 710 |
14 715 |
6 873 |
6 896 |
|
日期 |
8.11-8.17 |
8.18-8.24 |
8.11-8.17 |
8.18-8.24 |
8.11-8.17 |
8.18-8.24 |
|
住宅均价 |
32 521 |
32 386 |
14 700 |
14 688 |
6 904 |
6 439 |
1.下列关于城市住宅区的叙述,正确的是 ( )A.住宅区是城市中最为广泛的土地利用方式
B.高级住宅区一般分布在地价较高的市中心附近
C.文化程度是住宅区分化的最常见原因
D.住宅区趋向于沿主要交通干线分布
2.下列关于上海市从中心区到外环以外房价变化规律及影响因素对应正确的是 ( )
A.逐渐降低--交通因素 B.逐渐升高--土地价格
C.逐渐升高--人口密度 D.逐渐降低--土地价格
答案 1.A 2.D
17.(上海理综35、36、38)化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是
① 以上反应是可逆反应 ② 以上反应不是可逆反应
③ 充电时化学能转变为电能 ④ 放电时化学能转变为电能
A ①③ B ②④ C ①④ D ②③
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍锡电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重。这是因为
(3)另一种常用的电池是锂电池(很是一种碱金属元素,其相对原子质量为7,由于它的比容量(单位质量电板材料所能转换的电量)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年。它的负极用金属锂制成;电池总反应可表示为:Li+MnO2→LiMnO2
试回答:锂电池比容量特别大的原因是 锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因
16.燃料电池是使气体燃料氧化直接产生电流的装置,这是本世纪最具挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入丁烷,电池的电解质是掺杂了Y2O3(三氧化二钇)的Zr2O2(二氧化锆)晶体,它在高温下能传导
O2-。试回答下列问题:
⑴ 该电池放电时的化学反应方程式为 。
⑵ 该燃料电池的电极反应式为:
电池正极13O2+52e-=26O2- 电池负极 2C4H10+26O2--52e-=8CO2+10H2O
则固体电解质中的O2-向 极移动(填“正”或“负”)
⑶ 某金属的相对原子质量为52.00,用上述电池电解该金属的一种含氧酸盐的酸性水溶液时,阳极每放出3360mL(标准状况)氧气,阴极析出金属10.4g,在该含氧酸盐中金属的化合价为 ,在该实验中,若不考虑能量的损失,电池中消耗丁烷的质量最少是 g(结果精确至0.01g)
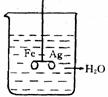
15. 如右图:
⑴ 在银圈和铁圈(用细塑料棒连接)的连接处吊着一个绝缘的细丝,使之平衡,然后小心地从烧杯中央滴入CuSO4溶液。①片刻后可观察到的现象是________,
②产生上述现象的原因是_________________________________。
⑵ 将⑴中细塑料棒取下, 使两环靠拢, 连接处吊着一个绝缘的细丝,调整圈的大小, 使 之平衡, 然后小心地从烧杯中央滴入CuSO4溶液。①片刻后可观察到的现象是_______ ___,②产生上述现象的原因是___________________________ ______。
14.市场上出售的“热敷袋”其主要成分是铁屑、碳粉、木屑和少量氯化钠、水等,热敷袋启用之前用塑料袋密封使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量,使用完后,会发现有大量的铁锈存在,请回答下列问题:
 ⑴ 热敷袋使用时,为什么会放出热量?
⑴ 热敷袋使用时,为什么会放出热量?
⑵ 碳粉的主要作用是什么?氯化钠又起了什么作用?
⑶ 试写出有关的电极反应式和化学方程式。
13.常用锌锰干电池在放电时的总反应可表示为:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O。该电池Zn作负极,发生 (选填“氧化”或“还原”)反应;若电池放电时,有0.1mol电子转移,消耗Zn的质量是 。
12.(2006广东16题)某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4==Li2Mn2O4。下列说法正确的是
A.放电时,LiMn2O4发生氧化反应
B.放电时,正极反应为:Li++LiMn2O4+e-==Li2Mn2O4
C.充电时,LiMn2O4发生氧化反应
D.充电时,阳极反应为:Li++e-==Li
11.(2006江苏14题)锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为
负极反应:C6Li-xe-===C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成复合材料)
正极反应:Li1-xMO2+xLi++x e-===LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列有关说法正确的是
A.锂离子电池充电时电池反应为C6Li+Li1-xMO2===LiMO2+C6Li1-x
B.电池反应中,锂、锌、银、铅各失去1mol电子,金属锂所消耗的质量最小
C.锂离子电池放电时电池内部Li+向负极移动
D.锂离子电池充电时阴极反应为C6Li1-x+xLi++x e-===C6Li
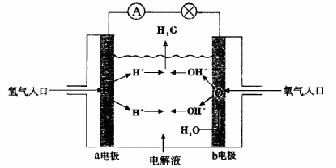
10.右图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
A.a电极是负极 B.b电极的电极反应为:
4OH――4e-=2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
9.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
 D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g
D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com