
1.微型钮扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH―-2e-=ZnO+H2O ,Ag2O+H2O+2e-=2Ag+2OH-,总反应为:Ag2O+Zn=2Ag+ZnO。根据上述反应式,判断下列叙述中,正确的是
A.在使用过程中,电池负极区溶液pH增大
B.在使用过程中,电流由Ag2O极经外电路流向Zn极
C.在使用过程中,Zn电极发生还原反应,Ag2O电极发生氧化反应
D.外电路中每通过0.2mol电子,正极的质量理论上减小1.6g
[例1]A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
⑴ A中反应的离子方程式为 ;
⑵ B中Sn极的电极反应式为_ __ ______,Sn极附近溶液的pH(填“增大”、“减小”或“不变”)_________;
⑶ C中被腐蚀的金属是_______,总反应式为
;A、B、C中铁被腐蚀的速率又快到慢的顺序为 。
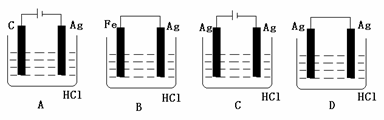
[例2]某学生欲完成2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的实验是
[例3]出现于20世纪50年代的镍(Ni)镉(Cd)电池是一种可充电碱性电池,至今仍占有很大的市场份额,但由于镉是致癌物质,故镍镉电池有逐渐被其它可充电电池取代的趋势。镍镉电池以氢氧化钾为电解质溶液,电池在充、放电时的工作原理为:

Cd(s)+2NiOOH(s)+2H2O(l) Cd(OH)2(s)+2Ni(OH)2(s)
下列关于镍镉电池的说法错误的是
A.电池工作时的负极反应是:Cd(s)+2OH-(aq)=Cd(OH)2(s)+2e-
B.充电时的阳极反应是:Ni(OH)2(s) +OH-(aq)=NiOOH(s)+H2O(l)+e-
C.作为电解池时电解质溶液质量增加,作为原电池时电解质溶液质量减少
D.电池工作时,负极区pH增大,正极区pH减小,但整个电池的pH基本保持不变
5.金属的防护以及金属腐蚀的快慢规律
(1)金属防护的几种重要方法
①改变金属内部的组成结构,将金属制成合金,增强抗腐蚀能力。
②在金属表面覆盖保护保护层,使金属和周围物质隔离开来。
③电化学保护法:利用电化学反应使金属钝化而受到保护,或者利用原电池反应将需要保护的金属作为电池的正极而受到保护。
(2)金属腐蚀的快慢规律:
①在同一电解质溶液中, 。
②对同一种金属来说,腐蚀的快慢:
③活动性不同的两金属,活泼性差别越 , 极金属腐蚀越快。
④对同一电解质溶液来说,电解质溶液浓度越 ,腐蚀越快。
(3)防腐措施由好到坏的顺序:
。
4.金属的腐蚀及其本质:
金属的腐蚀是 跟周围接触到的 进行 反应而腐蚀损耗的过程,其本质是金属原子 电子被 的过程。
⑴ 化学腐蚀与电化腐蚀
|
|
化学腐蚀 |
电化腐蚀 |
|
条件 |
|
|
|
现象 |
|
|
|
本质 |
|
|
|
联系 |
|
⑵ 析氢腐蚀与吸氧腐蚀
|
|
析氢腐蚀 |
吸氧腐蚀 |
|
条 件 |
|
|
|
电极 反应 |
负极 |
|
|
正极 |
|
|
|
总反应式 |
|
|
3.化学电源及其电极反应式:
(1)干电池:
电极反应:负极 ,正极:2MnO2 + 2NH4+ + 2e-== Mn2O3 + 2NH3↑ + H2O
总反应: 2NH4+ + Zn +2MnO2= Zn 2++H2O+2NH3↑
(2)铅蓄电池(电解质溶液为稀硫酸)
负极(Pb): 正极(PbO2):
总反应: PbO2+ Pb +2H2SO4 2PbSO4+2 H2O
(3)锂电池(非水有机溶剂电解液,为什么?)
锂跟相同质量的其他金属相比较,使用寿命长,高能、质轻、电压高、工作效率高\储存寿命长. 为什么?
(4)氢氧燃料电池
① 酸式(H+):负极 ; 正极:
总反应: 2H2+O2=2H2O
②碱式(OH-):负极 ; 正极:
总反应: 2H2+O2=2H2O
废旧电池中含有多种重金属和酸、碱等有害物质,随意丢弃,对生态环境和公众健康危害很大。废电池应该回收利用。
2.原电池中电极、电极反应、电子流向(以Zn|H2SO4|Cu原电池为例)
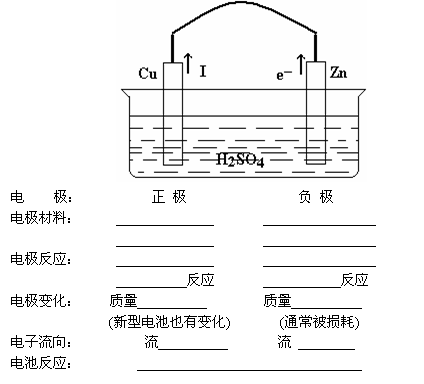
1.原电池是利用 反应,把 能转化成 能的装置。
构成原电池的条件:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com