
4.在25℃时,某稀溶液中由水电离产生的[H+]=10-13mol/L。有关该溶液的叙述正确的是
A .该溶液一定呈酸性 B .该溶液一定呈碱性
C .该溶液的pH值可能为1 D. 该溶液的pH值可能为13
3.25℃时,pH=2的HCl溶液中,由水电离出的H+浓度是 ( ).
A.1×10-7mol·L-1 B.1×10-12mol·L-1.
C.1×10-2mol·L-1 D.1×10-14mol·L-1.
2.常温下,在0.1 mol·L-1 CH3COOH溶液中,水的离子积是 ( )
A.1×10-14 B.1×10-13. C.1.32×10-14 D.1.32×10-15.
1.(1)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH= 。
(2)向pH=6的CH3COOH和c(H+)=10-6mol·L-1的稀盐酸中分别投入大小、质量相同的金属钠,反应刚开始时,产生H2的速率前者与后者相比是 (填选项序号)。
A.一样快 B.前者快 C.后者快 D.无法比较
2、水的离子积--纯水及电解质稀溶液中(c≤1mol·L-1)有c(OH-)·c(H+)=Kw,Kw只受温度影响,常温时(25℃)Kw=1×10-14,温度升高,水的电离程度增大。Kw亦增大,100℃,Kw=1×10-12。
计算题记牢公式c(OH-)·c(H+)=Kw计算时看是否是常温,不是常温要看该温度下的Kw值
1、水是极弱的电解质,原因能发生自电离 H2O+H2O H3O++OH-
H3O++OH-
简写成H2O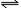 H++OH-,与其它弱电解质一样,其电离程度大小受温度及酸、碱、盐等影响。
H++OH-,与其它弱电解质一样,其电离程度大小受温度及酸、碱、盐等影响。
6.能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是 ( )
A.向水中投入一小块金属钠 . B.将水加热煮沸.
C.向水中通入二氧化碳气体. D.向水中加食盐晶体
第二节 水的电离和溶液的pH值
5.相同温度下,100mL 0.01mol/L的HF与10mL 0.1mol/L的HF相比较,下列数值前者大于后者的是 ( )
A.中和时所需NaOH的量 B.c (H+) C.电离程度 D.c (OH-)
4.在同一温度下,当弱电解质溶液a,强电解质溶液b,金属导体c的导电能力相同,若同时升高到相同温度,则它们的导电能力是 ( )
A. a>b>c B. a=b=c C. c>a>b D. b>c>a
3.有浓度为0.1mol·L-1的氨水,pH=11,用蒸馏水稀释100倍,则NH3·H2O的电离平衡向________(填“促进”或“抑制”)电离的方向移动,溶液的pH将变为____________(填序号)
A.9~11之间 B.11 C.12~13之间 D.13
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com