
11.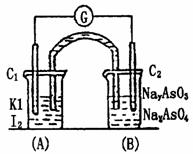 已知反应AsO43-+2I-+2H+
已知反应AsO43-+2I-+2H+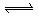 AsO33-+I2+H2O是可逆反应.设计如图装置,进行下述操作:
AsO33-+I2+H2O是可逆反应.设计如图装置,进行下述操作:
(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,发现微安培表
指针偏转;
(Ⅱ)若改往(B)烧杯中滴加40%NaOH溶液,发现
微安培表指针向前述相反方向偏转.试回答:
(1)两次操作过程中指针为什么会发生偏转?
答: 。
(2)两次操作过程中指针偏转方向为什么会相反?试用平衡移动原理解释此现象.
答:
(3)(Ⅰ)操作过程中C1棒上发生的反应为 。
(4)(Ⅱ)操作过程中C2棒上发生的反应为 。
10.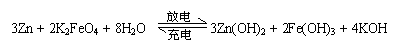 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为
下列叙述不正确的是
A.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
B.充电时阳极反应为:Fe(OH)3 -3e- + 5 OH-
= FeO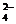 + 4H2O
+ 4H2O
C.放电时负极反应为:Zn-2e- +2OH-= Zn(OH)2
D.放电时正极附近溶液的碱性增强
9. 镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:
Cd(OH)2+2Ni(OH)2 Cd+2NiO(OH)+2H2O
由此可知,该电池放电时的负极材料是 ( )
A.Cd(OH)2 B.Ni(OH)2 C.Cd D.NiO(OH)
7.某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4==Li2Mn2O4。下列说法正确的是 ( )
A.放电时,LiMn2O4发生还原反应
B.放电时,正极反应为:Li++LiMn2O4+e-==Li2Mn2O4
C.充电时,LiMn2O4发生氧化反应
D.充电时,阳极反应为:Li++e-==Li
8. 据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH
+ 3O2 + 4OH- 2CO32-
+ 6H2O,则下列说法错误的是
( )
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH
+ 3O2 + 4OH- 2CO32-
+ 6H2O,则下列说法错误的是
( )
A.放电时CH3OH参与反应的电极为正极
B.充电时电解质溶液的pH逐渐增大
C.放电时负极的电极反应为:CH3OH-6e-+8OH- = CO32- + 6H2O
D.充电时每生成1 mol CH3OH转移6 mol电子
6.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连可以组成几个原电池。若a、b 相连时a为负极;c、d相连时电流由d到c;a、c相连时c极上产生大量气泡;b、d相连时b上 有大量气泡产生,则四种金属的活动性顺序由强到弱为 ( )
A.a>b>c>d B.a>c>d>b
C.c>a>b>d D.b>d>c>a
5.下列说法不正确的是 ( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.原电池中两电极只能是活泼性不同的金属
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
4.埋在地下的输油铸铁管道,在下列各种情况下,被腐蚀的速度最慢的是 ( )
A.在潮湿疏松透气的土壤中 B.在干燥致密不透气的土壤中
C.在含铁元素较多的酸性土壤中 D.在含碳粒较多,潮湿透气的土壤中
3.下列各变化中属于原电池反应的是
A.在空气中金属铝表面迅速氧化形成保护层 ( )
B.镀锌铁表面有划损时,也能阻止铁被氧化
C.红热的铁丝与冷水接触,表面形成蓝黑色保护层
D.浓硝酸比稀硝酸更能氧化金属铜
2.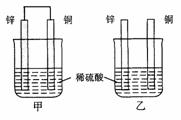 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com