
6、0.1mol/L的下列溶液①NH4Cl ②NH4HSO4 ③NH3·H2O ④(NH4)2SO4,
按C(NH4+)由大到小的顺序排列为 。
5、NH4Cl溶液中,下列叙述错误的是 ( )
A. c(NH4+)>c(Cl-) >c(OH- ) >c( H+ ) B. c(Cl-)>c(NH4+)>c( H+ )>c(OH- )
C. c(NH4+) + c( H+ ) = c(Cl-) + c(OH- ) D. c(NH4+) + c( NH3 · H2O ) = c(Cl-)
4、某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法正确的是( )
A、若溶液中c(A-)== c(Na+),则溶液一定呈中性
B、溶液中不可能存在:c(Na+)>c (A-)>c(OH-)>c(H+)
C、若c(OH-)>c(H+),溶液中不可能存在:c(Na+)>c(OH-)>c(A-)>c(H+)
D、若溶质为NaA、HA,则一定存在: c(A-)>c(Na+)>c(H+)>c(OH-)
3、25℃时,将0.02mol·L-1的HCOOH溶液与0.01mol·L-1的NaOH溶液等体积混合,所得溶液的pH<7。则下列关系式中不正确的是( )
A、c(HCOO-)> c(Na+) B、c(HCOOH)< c(HCOO-)
C、c(HCOOH)+ c(HCOO-)=0.02mol·L-1 D、2 c(H+)+ c(HCOOH)= c(HCOO-)+2 c(OH-)
2、醋酸钡[(CH3COO)2Ba·H2O]是一种媒染剂,有关0.1mol/L醋酸钡溶液中粒子浓度比较不正确的是( )
A、c(Ba2+) >c(CH3COO-)>c(OH-)>c(H+) B、c(H+)+2c(Ba2+)= c(CH3COO-) +c(OH-)
C、c(H+) = c(OH-)-c(CH3COOH) D、2c(Ba2+)= c(CH3COO-)+ c(CH3COOH)
1、在0.1 mol·L-1的Na2CO3溶液中,下列关系正确的是( )
A、c(Na+)> c(CO32-)> c(HCO3-)> c(OH-)> c(H+)
B、c(Na+)> c(CO32-)> c(OH-)> c(HCO3-)> c(H+)
C、c(Na+)+ c(H+)= c(OH-)+c(CO32-)+ c(HCO3-)
D、c(OH-)= c(H+)+ c(HCO3-)+2c(H2CO3)
3、下列离子反应方程书写正确的是 ( )
A. H2O + H2O 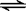 H3O+
+ OH-
B. CO32-+ 2H2O
H3O+
+ OH-
B. CO32-+ 2H2O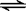 H2CO3 + 2OH-
H2CO3 + 2OH-
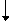
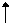 C. Ca(OH)2
+ 2H+
C. Ca(OH)2
+ 2H+ 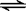 Ca2+ + 2H2O
D.2Al3++3CO32-+3H2O
= 2Al(OH)3 +3CO2
Ca2+ + 2H2O
D.2Al3++3CO32-+3H2O
= 2Al(OH)3 +3CO2
②生活实例:
泡沫灭火器原理:
Na HCO3水解
Al2(SO4)3水解
离子方程式
施用化肥:普钙、氨态氮肥不能与 混用。
原因:
(5)分析盐溶液中离子浓度大小(繁琐)见重难点手册P177-180讲解
2、下列说法中,不正确的是( )
A、室温下,CH3COOH分子可以存在于pH=8的碱性溶液中
B、在0.1mol•L-1的氢溴酸中加入适量的蒸馏水,溶液的c(H+)减小
C、在由水电离出的c(OH-)=1×10-12mol•L-1的溶液中,Al3+不可能大量存在
D、在NaAlO2溶液中,HCO3-不可能大量存在
(1)判断溶液的酸碱性:
①水解呈碱性的溶液,保存时试剂瓶要用橡胶塞。
②根据盐溶液的酸碱性,可以证明酸、碱的强弱。
酸:选其强碱盐溶液,若该盐溶液呈中性,说明该酸是 ;若呈碱性说明该酸是 。
碱:选其强碱盐溶液,若该盐溶液呈中性,说明该碱是 ;若呈酸性说明该碱是 。
③根据同浓度(相同)强碱(不同)弱酸盐溶液的碱性强弱,可以比较弱酸的相对强弱。
弱酸越弱,说明对应的弱酸根离子水解程度越 。
几种同浓度(相同)强碱(不同)弱酸盐溶液碱性越强,对应酸的酸的酸性越 。
④某些活泼金属与强酸弱碱盐反应。(如:Mg放入NH4Cl、FeCl3溶液中产生氢气。)
⑤判断溶液中微粒种类:先看溶剂分子和溶剂电离产生的微粒,再看溶质电离产生的微粒,最后看溶剂和溶液相互作用产生的微粒;
练习:写出Na2CO3和Na3PO4溶液中的所有微粒
Na2CO3
Na3PO4
(2)解释一些化学现象
①无水AlCl3瓶盖打开有白雾,试解释原因:
②明矾、三氯化铁净水。(水解的离子反应方程式)
明矾净水
三氯化铁净水
原因:胶体粒子的表面积 ,吸附能力 , 而起净水作用。
例:铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比KMnO4更强,本身在反应中被还原为Fe3+,铁酸钠能净水的原因是
。
③用ZnCl2、NH4Cl作焊药:(生活知识介绍)
金属表面往往存在氧化膜,这种氧化膜的存在会使焊接不牢固(即出现虚焊现象),而用NH4Cl或ZnCl2作为焊接时的焊药则能够保证焊接的牢固。原因是 NH4Cl或ZnCl2水解显 ,这种酸性的溶液可以除去金属表面的氧化膜。
油条的制作口诀是“一碱、二矾、三盐”,其中碱、矾、盐分别是指:NaHCO3、
KAl(SO4)2·12H2O和NaCl,在面团中Al3+和HCO3-发生双水解反应,
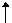
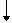 Al3++3HCO3-=Al(OH)3 +3CO2
Al3++3HCO3-=Al(OH)3 +3CO2
当面团被投入到沸腾的油中时,面团受热,其中的CO2体积增大, 致使面团膨胀为油条。
(3)盐类水解平衡的移动
①配制盐溶液。
配制FeCl3溶液要加入 ,配制Na2SiO3溶液加入 ,目的:
例:实验室在配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀硫酸中,再加水稀释到所需的浓度,这样操作的目的是 ( )
A、提高硫酸铁的溶解度 B、防止硫酸铁分解
C、降低溶液的pH D、抑制硫酸铁水解
②热的纯碱溶液清洗油污效果较好,原因:
③制备Fe(OH)3胶体的操作:
为什么用沸水? 。加热时间能不能太长?
原因
④采用加热的方法来促进溶液中某些盐的水解,使之生成氢氧化物沉淀,以除去溶液中某些金属离子。
例:KNO3溶液中有Fe3+,用什么方法除去?解释。
⑤判断盐溶液加热蒸干的产物:
例:将Na2CO3溶液加热蒸干后得到
提示:加热尽管促进水解,但是产生了NaOH,碱性条件下无CO2逸出。
小结:盐水解生成 时,蒸干后一般得到原物质。
将FeCl3溶液加热蒸干后得到 ,蒸干后再灼烧得到
提示:水解产生的HCl易挥发。最终会全部逸出。
小结:盐水解生成 时,蒸干后一般得到弱碱。
将Fe2(SO4) 3溶液加热蒸干后得到
提示:水解产生的H2SO4不易挥发,最终仍和水解产生的Fe(OH)3反应。
小结:盐水解生成 时,蒸干后一般得到原物质。
将NaHCO3溶液加热蒸干后得到 ,
提示:因为NaHCO3受热分解,所以最终得到固体不是NaHCO3。
小结:不稳定性盐的溶液加热蒸干时得到的固体与原盐的组成不同。
将Na2 SO3溶液加热蒸干后得到
提示:因为Na2 SO3具有还原性,容易被氧化。
小结:还原性盐的溶液加热蒸干时得到的固体与原盐的组成不同。
推广:将Al Cl3·6 H2O加热最终得到 ,原因
化学方程式 ,如果要得到无水Al Cl3固体,可以一边加热一边
通入 。目的 。
例:碳酸钠溶液中存在着Na2CO3+H2O 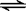 NaHCO3+NaOH的平衡,加热蒸干溶液,得到的固体是
NaHCO3+NaOH的平衡,加热蒸干溶液,得到的固体是
(A)Na2CO3 (B)NaHCO3和NaOH (C)NaOH (D)Na2CO3和NaOH
⑥制备纳米材料。例如,用TiCl4制备TiO2,
化学方程式
制备时加入大量的水,同时加热,促进水解趋于完全.所得 经焙烧得TiO2
(4)双水解问题(弱酸弱碱盐)(强酸弱碱盐和强碱弱酸同时溶于水)
①判断离子共存问题: 发生水解且相互促进反应的离子不能大量共存,如Fe3+、Al3+分别与
CO32-、HCO3-、AlO2-,Al3+与S2-等。
1、下列各组离子能在溶液中大量共存,且溶液呈碱性、透明的是
A、Na+、OH-、H2PO4-、NO3- B、AlO2-、K+、CO32-、Na+
C、Al3+、Cl-、AlO2-、Na+ D、Fe2+、K+、H+、NO3-
4.在常温下,将等体积的盐酸和氨水混和后,所得溶液的pH=7,则下列说法正确的是
(A)原来盐酸的物质的量浓度等于氨不的物质的量浓度
(B)所得溶液中c(NH4+)=c(Cl-)
(C)所得溶液中c(NH4+)+c(H+)=c(Cl-)
(D)所得溶液中c(NH4+)+c(NH3·H2O)=c(Cl-)
第三节 盐类的水解(课时5、6)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com