
1、化学反应速率
(1)概念:化学反应速率是用来衡量化学反应进行的快慢的物理量。
通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示化学反应速率。
(2)表示方法: v=△c/△t 固体或纯净液体v=△n/△t
(用不同物质表示的化学反应速率之比等于化学方程式中的各物质的化学计量系数比。)
25.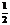 已知:H2(g)+ O2(g)=H2O(g),
反应过程中
已知:H2(g)+ O2(g)=H2O(g),
反应过程中
 能量变化如图。问:
能量变化如图。问:
(1)a、b、c分别代表什么意义?
a
b
c
(2)该反应是放热还是吸热?
△H大于0还是小于0?
24.硝化甘油(C3H5N3O9)分解的产物为N2、CO2、O2和H2O,它的分解反应方程式为
。已知20℃时,2.27 g硝化甘油分解放出热量为15.4 kJ,则每生成1 mol气体伴随放出的热量为___________ kJ。
23.1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体所释放出的热能为氯化钠晶体的晶格能。
(1)下列热化学方程式中,能直接表示出氯化钠晶体的晶格能的是
A. Na+(g)+Cl-(g)=NaCl(s) △H B. Na(s)+1/2Cl2(g)=NaCl(s) △H1
C.Na(s)=Na(g) △H2 D. Na(g)-e-=Na+(g) △H3
E.1/2 Cl2(g)= Cl(g) △H4 F. Cl(g)+ e-= Cl-(g) △H5
(2)写出△H与△H1、△H2、△H3、△H4、△H5之间的关系式
22.0.3mol气态高能燃料乙硼烷(B2H6)在O2中燃烧,生成固态的B2O3和液态水,放出649.5kJ热量,其燃烧热化学方程式为 。
又已知:H2O(l)== H2O(g)ΔH=44 kJ/mol ,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________________kJ。
21.1.00 L 1.00 mol·L-1 H2SO4溶液与2.00 L 1.00 mol·L-1 NaOH溶液完全反应,放出114.6 kJ的热量,由此可推知H2SO4与NaOH发生中和反应的中和热为___________,表示该中和热的热化学方程式为 。
20.家用液化气中主要成分之一是丁烷。在101 kPa时,10 kg丁烷完全燃烧生成CO2和H2O(l)放出热量5×105 kJ,丁烷的燃烧热为_________,丁烷燃烧的热化学方程式为_______________________
。
19.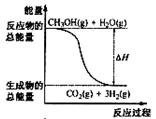 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H= + 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ·mol-1
下列说法正确的是 ( )
A.CH3OH的燃烧热为192.9 kJ·mol-1
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应: CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
18.强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+ OH- (aq) == H2O(l) △H= -57.3KJ/mol,向1L 0.5mol/L的NaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,则恰好完全反应时的热效应ΔH1、ΔH2、ΔH3的关系正确的是 ( )
A.ΔH1﹥ΔH2﹥ΔH3 B.ΔH1﹤ΔH3﹤ΔH2
C.ΔH2﹥ΔH1﹥ΔH3 D.ΔH1﹥ΔH3﹥ΔH2
17.下列各组热化学方程式中,化学反应的△H前者大于后者的是 ( )
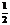 ①C(s)+O2(g)===CO2(g);△H1 C(s)+O2(g)===CO(g);△H2
①C(s)+O2(g)===CO2(g);△H1 C(s)+O2(g)===CO(g);△H2
②S(s)+O2(g)===SO2(g);△H3 S(g)+O2(g)===SO2(g);△H4
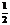
③H2(g)+O2(g)===H2O(l);△H5 2H2(g)+O2(g)===2H2O(l);△H6
④CaCO3(s)===CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)===Ca(OH)2(s);△H8
A.① B.④ C.②③④ D.①②③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com