
4、碳铵[(NH4)2CO3]在室温下就能自发地分解产生氨气,对其说法中正确的是
A.碳铵分解是因为生成了易挥发的气体,使体系的熵增大。
B.碳铵分解是因为外界给予了能量
C.碳铵分解是吸热反应,根据能量判据不能自发分解
D.碳酸盐都不稳定,都能自发分解。
3、知道了某过程有自发性之后,则
A.可判断出过程的方向 B.可确定过程是否一定会发生
C.可预测过程发生完成的快慢 D.可判断过程的热效应
2、已知金刚石和石墨在氧气中完全燃烧的热化学方程式为:
① C(金刚石、s)+O2(g) = CO2(g) △H1=-395.41 kJ·molˉ1
② C(石墨、s)+O2(g) = CO2(g) △H2=-393.51 kJ·molˉ1
关于金刚石与石墨的转化,下列说法正确的是
A.金刚石转化成石墨是自发进行的过程 B.石墨转化成金刚石是自发进行的过程 C.石墨比金刚石能量低 D.金刚石比石墨能量低
1、以下自发反应可用能量判据来解释的是
A.硝酸铵自发地溶于水
B.2N2O5(g) = 4NO2(g)+O2(g) △H = + 56.7 kJ·molˉ1
C.(NH4 )2CO3(s) = NH4HCO3(s)+NH3(g) △H = + 74.9 kJ·molˉ1
D.2H2(g)+O2(g) = 2H2O(l) △H= -571.6 kJ·molˉ1
11、②;③。12、①不变 ②增大;增大 ③不变;不变 ④减小;减小。13.m=2,n=1 ;大于。14、(1)2.73×10-8 mol/(L· s);(2)3.89×10-8 mol/(L· s),故比开始时快。
14.丙酮和碘在酸性溶液中发生下列反应:CH3COCH3+I2→CH3COCH2I+H++Iˉ。
25℃时,该反应的速率由下列经验式决定:V=2.73×10ˉ5· c(CH3COCH3)·c(H+)mol·Lˉ1·sˉ1;25℃时,如果c(I2)、c(CH3COCH3)、c(H+)的起始浓度依次是0.01 mol·Lˉ1,0.1 mol·Lˉ1,0.01 mol·Lˉ1。求:(1)反应开始时的速率是多少?(2)当溶液中的I2消耗一半时,反应速率比开始时慢还是快?
第二节 影响化学反应速率的因素
13.Fe3+和Iˉ在水溶液中的反应如下:2Iˉ+2Fe3+ = 2Fe2++I2(水溶液)。正向反应速率和Iˉ、Fe3+的浓度关系为 υ = k C(Iˉ)m C(Fe3+) n (k为常数)
|
|
C(Iˉ)(mol·Lˉ1) |
C(Fe3+)( mol·Lˉ1)
|
υmol·Lˉ1·sˉ1 |
|
(1) |
0.20 |
0.80 |
0.032k |
|
(2) |
0.60 |
0.40 |
0.144k |
|
(3) |
0.80 |
0.20 |
0.128k |
通过所给数据计算得知:
(1)在υ = k C(Iˉ)m C(Fe3+) n中,m、n的值为m=_________,n=_________;
(2)碘离子浓度对反应速率的影响______铁离子浓度对反应速率的影响。(填:<、>、=)
12.反应3Fe(S)+4H2O = Fe3O4(s)+4H2(g),在一可变的容积的密闭容器中进行,试回答:
(1)增加Fe的量,其正反应速率的变化是_________(填增大、不变、减小,以下相同)
(2)将容器的体积缩小一半,其正反应速率_________ ,逆反应速率_________。
(3)保持体积不变,充入N2使体系压强增大,其正反应速率_____,逆反应速率_________。
(4)保持压强不变,充入N2使容器的体积增大,其正反应速率_____,逆反应速率_____。
11.在密闭容器中发生2SO2+O2 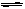 2SO3反应,现控制下列三种不同的条件:
2SO3反应,现控制下列三种不同的条件:
①在400℃时,10molSO2与5molO2反应;
②在400℃时,20molSO2与5molO2反应;
③在300℃时,10molSO2与5molO2反应;
问:开始时,正反应速率最快的是_________;正反应速率最慢的是_________。
10.对于密闭容器中进行的反应:N2+O2=2NO,下列条件中哪些能加快该反应速率的
A.缩小体积使压力增大 B.体积不变充入N2使压强增大
C.体积不变充入He气使压强增大 D.减小压强使体积增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com