
17. (1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。
该反应中还原产物是______;若反应过程中转移了0.3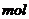 电子,则氧化产物的质量是______
电子,则氧化产物的质量是______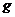 。
。
(2)将a mol Cl2 通入含b mol FeBr2的溶液中,当0< a / b≤1/2 时,反应的离子方程式为:
2Fe2+ + Cl2 = 2Fe3+ + 2Cl- ,写出另2个可能发生的离子方程式
① 当 a / b =1时____________________________________________;
② 当a / b≥3/2时____________________________________________。
③ (3)观察如下反应,总结规律,然后完成下列问题:
①Al(OH)3 +H2O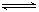 Al(OH)4- + H+ ②NH3+H2O
Al(OH)4- + H+ ②NH3+H2O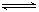 NH4+ + OH_
NH4+ + OH_
(A)已知B(OH)3是一元弱酸,试写出其电离方程式__________________________________
(B)N2H4是二元弱碱,试写出其第二步电离方程式____________ ____
16.(1)配平氧化还原反应方程式:
__ C2O42-+__MnO4-+__H+= __CO2+__Mn2++__H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为 mol;
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由 变为 。该溶液中还原剂的物质的量为 mol;
③原试样中H2C2O4·2H2O和KHC2O4的质量分数分别是多少?
(请列式计算,写出运算过程)
15. 某化学兴趣小组利用实验室提供的下列试剂:铁粉、0.1mol·L-1FeCl3溶液、0.1mol·L-1FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+ 、Fe3+ 的氧化性、还原性,并对实验结果加于应用。
(1)根据氧化还原的有关原理,兴趣小组对Fe2+、Fe3+ 的氧化性、还原性提出了如下2种假设:
假设一:Fe2+ 既有还原性又有氧化性;
假设二:Fe3+ 具有氧化性;
|
探究内容 |
实验方案 |
实验现象 |
|
探究Fe2+具有还原性 |
取少量0.1mol·L-1FeCl2溶液,加入足量新制氯水后,再往溶液中加入少量KSCN溶液 |
|
|
探究Fe3+具有氧化性 |
|
|
(2)设计实验方案,进行实验并描述实验现象,完成下列表格。
(3)该兴趣小组为说明“Fe2+具有氧化性”,提出了一个反应事实:FeCl2 + Zn = ZnCl2 + Fe
该反应的离子方程式为:
(4)根据Fe3+的性质,该兴趣小组利用FeCl3溶液腐蚀铜箔制造印刷线路板,反应的离子方程式是:
14. CuCl2溶液中含有少量杂质FeCl2,为制备纯净的CuCl2·2H2O晶体,拟定实验步骤如下图所示:
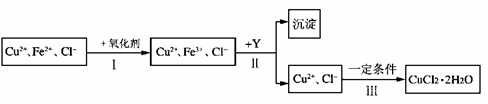
请回答下列问题:
(1)步骤Ⅰ中,将Fe2+转化为Fe3+最好选用下列氧化剂中的 (填字母)。
A.K2Cr2O7 B.NaClO C.H2O2
该反应的离子方程式为 。
(2)在步骤Ⅱ中,①加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以是下列物质中的 (填字母);
A.NaOH B.Cu C.Cu2(OH)2CO3
②江河入海口处易形成沙洲的原因是江水中的胶粒遇海水中的电解质发生凝聚。将步骤Ⅱ中沉淀制成胶体后,再逐滴加入稀硫酸可能看到的现象是 。
(3)步骤Ⅲ应控制的实验条件是 。
13. 已知硫酸亚铁溶液中加入过氧化钠时发生反应:
4Fe2++4Na2O2+6H2O = 4Fe(OH)3↓+O2↑+8Na+ 则下列说法正确的是 ( )
A.该反应中Fe2+是还原剂,O2是还原产物
B.4molNa2O2在反应中共得到8NA的电子
C.Fe(OH)3是氧化产物,每生成4mol Fe(OH)3反应过程中共转移电子6mol
D.反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀
12. 有Fe2+、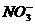 、Fe3+、
、Fe3+、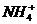 、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
( )
、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
( )
A.氧化剂与还原剂的物质的量之比为1︰8
B.该过程说明Fe( NO3)2溶液不宜加酸酸化
C.若有l mol NO3-发生氧化反应,则转移8mol e-
D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+
11. 在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:
3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M
关于该反应的说法中正确的组合是 ( )
① 氧化剂是H3AsO3;② 还原性:Cl->As;③ 每生成7.5gAs,还原剂失去的电子为0.3 mol;④ M为OH-;⑤ SnCl62-是氧化产物。
A.①③⑤ B.①②④⑤
C.①②③④ D.只有①③
10.据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生的化学方程式为: 5KClO3 + 6P=3P2O5 + 5KCl ,则下列有关叙述错误的是 ( )
A.上述反应是氧化还原反应
B.白色烟雾是生成的P2O5白色固体小颗粒(烟)吸水性强,吸收空气中的水,生成磷酸小液滴(雾)
C.因红磷和白磷互为同分异构体,所以上述火药中的红磷可以用白磷代替
D.上述反应中消耗3molP时,转移电子的物质的量为15mol
9. a mol FeS与b mol FeO投入到VL、c mol/L的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④Vc-(9a+b)/3mol
A.①④ B.②③ C.①③ D.②④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com