
2. 磷单质及其化合物的、有广泛应用
(1)同磷灰石[主要成分]在高温下制备黄磷(P4)的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)
; H
H
①上述反应中,副产物矿渣可用来 。
②已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)=6Cas3(PO4)2(s)+2CaSio3(s)+SiF4(g) ;△H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g);△H2
SiO2(s)+CaO(s)=CaSiO3(s) ;△H3
 用△H1、△H2和△H3表示
用△H1、△H2和△H3表示 H,
H, H=
。
H=
。
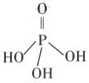
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式见右图)之间脱去两个水分子产物,其结构式为 。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为 。
(3)次磷酸钠(NaH2PO2)可用于化学镀镍。
①NaH2PO2中P元素的化合价为 。
②化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a) Ni2+ + H2PO2-+ → Ni++ H2PO3-+
(b)6H2PO-2
+2H+ =2P+4H2PO3+3H2↑
请在答题卡上写出并配平反应式(a)。
③利用②中反应可在塑料镀件表面沉积镍-磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
方法上的不同点: ;原理上的不同点: ;化学镀的优点: 。
[答案](1)水泥;△H1-3△H2+18△H3(2)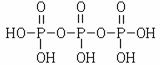 ,Na5P3O10,(3)+1;2Ni2+ + 1H2PO2-+ 1H2O
→ 2 Ni+ +1H2PO3-+ 2 H+(4)化学镀中镀件直接与电解质溶液接触反应;电镀通过外加电流,在镀件外形成镀层 ;化学镀是利用化学腐蚀反应;电镀是利用电解池,外加电流进行氧化还原反应 ; 装置简便,节约能源,操作简便 。
,Na5P3O10,(3)+1;2Ni2+ + 1H2PO2-+ 1H2O
→ 2 Ni+ +1H2PO3-+ 2 H+(4)化学镀中镀件直接与电解质溶液接触反应;电镀通过外加电流,在镀件外形成镀层 ;化学镀是利用化学腐蚀反应;电镀是利用电解池,外加电流进行氧化还原反应 ; 装置简便,节约能源,操作简便 。
[解析](1)①由方程式可以看出副产物矿渣应该是CaSiO3(s),结合炼铁我们不难得出答案是制水泥
②运用盖斯定律,反应1-反应2×3+反应3×18=总反应,则△H=△H1-3△H2+18△H3
(2)结合题意三聚磷酸钠(俗称“五钠”)可知产物三聚磷酸应含有五个羟基,即三个
磷酸分子之间有三个羟基相互反应脱去两个水分子,所以三聚磷酸的结构式为
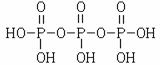 ,三聚磷酸钠的化学式为Na5P3O10。
,三聚磷酸钠的化学式为Na5P3O10。
(3)①因为Na、H的化合价为+1,O为-2,所以由化合价代数和为0可得P的化合价为:+1。
②由得失电子数目守恒(2-1)×2=(3-1)×1,可知Ni2+ 和Ni+的化学计量数为2,H2PO2-和H2PO3-的化学计量数为1,再由电荷守恒2×2-1=2×1-1+2×1,可知H+在方程式的右边,H2O在方程式的左边,化学计量数分别为2和1。即总方程式为:2Ni2+ +1H2PO2-+ 1H2O → 2 Ni+ +1H2PO3-+ 2 H+
③ 比较化学镀与电镀应该从反应环境和条件以及反应实质和产物方面去分析归纳问题,从方法上分析,电镀是利用电解原理通过外加直流电源,在镀件表面形成的镀层,镀层一般只有镍,而化学镀是利用氧化还原反应镀件直接与电解质溶液接触,在塑料镀件表面沉积镍
④ -磷合金,这是两者的不同;从原理上分析,无论电镀还是化学镀均有电子的转移,均是利用了氧化还原反应,这是两者的相同点,不同点是化学镀用的是化学反应,而电镀用的是电化学;很明显化学镀装置简单,而且不需要消耗电能,装置简单、耗能少、操作简便应该是化学镀优于电镀的。
[考点分析]氧化还原反应综合应用
1. 为测试一铁片中铁元素的含量,某课外活动小组提出下面两种方案并进行了实验(以下数据为多次平行实验测定结果的平均值):
方案一:将a g铁片完全溶解于过量稀硫酸中,测得生成氢气的体积为580mL(标准状况);
方案二:将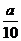 g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000mol·L-1
g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000mol·L-1
的KMnO4溶液滴定,达到终点时消耗了25.00mL KMnO4溶液。
请回答下列问题:
(1)配平下面的化学方程式(将有关的化学计量数填入答题卡的横线上):
□KMnO4+□FeSO4+□H2SO4=□Fe2(SO4)3+□MnSO4+□K2SO4+□H2O
(2)在滴定实验中不能选择 式滴定管,理由是 ;
(3)根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为 和
;(铁的相对原子质量以55.9计)
(4)若排除实验仪器和操作的影响因素,试对上述两种方案测定结果的准确性做出判断和分析。
①方案一 (填“准确”“不准确”“不一定准确”),理由是 ;
②方案二 (填“准确”“不准确”“不一定准确”),理由是 。
答案:(1)2;10;8;5 ;2;1;8。
(2)碱;KMnO4是强氧化剂,它会腐蚀乳胶管
(3)×100%;×100%。
(4)①不一定准确。如果铁片中存在与稀硫酸反应并能生成氢气的其他金属,会导致结果偏高;铁片中存在与稀硫酸反应而溶解、但不产生氢气的铁的氧化物,会导致结果偏低;如果上述情况均不存在,则结果准确。
②不一定准确。如果铁片中存在与稀硫酸反应而溶解的其他金属,生成的金属离子在酸性溶液中能被高锰酸钾氧化,会导致结果偏高;如果铁片中存在与稀硫酸反应而溶解的铁的氧化物,生成的Fe3+离子在酸性溶液中不能被高锰酸钾氧化,会导致结果偏低;如果上述情况均不存在,则结果准确
注:本小题属于开放性试题,若考生回答“准确”或“不准确”且理由合理,可酌性给分。例如:考生回答
方案一准确,因为铁片中不存在能与稀硫酸反应并能生成氢气的其他金属,也不存在铁的氧化物
方案一不准确,如果铁片中存在与稀硫酸反应生成氢气的其他金属,会导致结果偏高;如果存在与稀硫酸反应而溶解、但不产生氢气的铁的氧化物,会导致结果偏低
方案二准确,铁片溶于稀硫酸后,除Fe2+外,其他可能存在的金属离子在酸性溶液中均不能被高锰酸钾氧化,也不存在氧化铁
方案二不准确,如果铁片中存在与稀硫酸反应而溶解的其他金属,生成的金属离子在酸性溶液中能被高锰酸钾氧化,会导致结果偏高;如果存在与稀硫酸反应而溶解的铁的氧化物,千百万的Fe3+离子在酸性溶液中不能被高锰酸钾氧化,会导致结果偏低
[解析](1)Mn:+7→+2,改变数为5,Fe:+2→+3,改变数为2,根据化合价升降的总数相等,所以在Fe2(SO4)3前配5,MnSO4强配2,然后在根据方程式两边的原子个数相等配平其它元素的原子。配平后的化学方程式为:2KMnO4+10FeSO4+8H2SO4===5Fe2(SO4)3+2MnSO4+K2SO4+8H2O。
(2)不能选用碱式滴定管,因为碱式滴定管的下端有一段橡皮管,以被酸性的kmno4氧化而被腐蚀。
(3)由电子守恒得:方法一:×2=×2,m(Fe)=1.45g,Fe的质量分数为:×100%。方法二:×1=0.02000mol·L-1×0.025L×5,m(Fe)=0.140g,×100%=×100%。
(4)①不一定准确。如果铁片中存在与稀硫酸反应并能生成氢气的其他金属,会导致结果偏高;铁片中存在与稀硫酸反应而溶解、但不产生氢气的铁的氧化物,会导致结果偏低;如果上述情况均不存在,则结果准确。
②不一定准确。如果铁片中存在与稀硫酸反应而溶解的其他金属,生成的金属离子在酸性溶液中能被高锰酸钾氧化,会导致结果偏高;如果铁片中存在与稀硫酸反应而溶解的铁的氧化物,生成的Fe3+离子在酸性溶液中不能被高锰酸钾氧化,会导致结果偏低;如果上述情况均不存在,则结果准确
[考点分析]纵观近几年高考命题的发展趋势,氧化还原反应除主要考查基本概念外,出现了将氧化还原反应方程式的配平与相关的分析推断相综合的趋势,以及信息迁移、探讨新问题情景的研究题。因此解题时,应注重将氧化还原反应的相关化学知识,按内在联系抽象归纳,逻辑地统摄成规律,并按此规律进行推理和想象。
16. 三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO 和 HNO3 ,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素的物质的量之比为_______________。
(2)写出该反应的化学方程式,用双线桥标出电子转移的方向和数目:
______________________________________________________________________。
若反应中生成0.2 mol HNO3,转移的电子数目为______________________个。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是 。
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染。其产物除H2O外,还有另三种钠盐:______ ______(填化学式)。
答案(1)1:2
(2)3 NF3 + 5 H2O =2 NO + HNO3 + 9 HF
(双线桥略) ,0.4NA或2.408×1023
(3)产生红棕色气体、产生刺激性气味气体、产生白雾
(4)NaNO3、NaF、NaNO2
[专题综合]
15. 白磷(P4)是一种常见的晶体,可用于制备较纯的磷酸。
(1)白磷是_______晶体,31g白磷与足量的氧气完全燃烧释放出745.5kJ的热量,请写出白磷燃烧的热化学反应方程式:_________________________________________;
(2)已知白磷和氯酸溶液可发生如下反应:
P4 + HClO3 + === HCl + H3PO4
配平并完成上述反应方程式,该反应的氧化剂是______________。
(3)白磷有毒,有实验室可采用CuSO4溶液进行处理,其反应为:
11P4 + 60CuSO4 + 96H2O === 20Cu3P + 24 H3PO4 + 60 H2SO4
该反应的氧化产物是______________,若有1.1mol P4反应,则有________mol电子转移。
[答案](1) 分子) P4(s)
+ 5O2(g) === 2P2O5(s);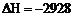 kJ/mol
kJ/mol
(2) 3 P4 + 10 HClO3 + 18 H2O = 10 HCl + 12 H3PO4 ;HClO3 (3) H3PO4) ;12
14. 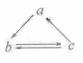 下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
|
|
a |
b |
c |
|
A |
Al |
AlCl3 |
Al(OH)3 |
|
B |
HNO3 |
NO |
NO2 |
|
C |
Si |
SiO2 |
H2SiO3 |
|
D |
CH2=CH2 |
CH3CH2OH |
CH3CHO |
[答案]B
13. 钢铁“发蓝”是在钢铁的表面形成一层四氧化三铁的技术过程。其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到130℃反应。其过程可以用如下化学方程式表示:① 3Fe+NaNO2+5NaOH→3Na2FeO2+H2O+NH3↑;
② 6Na2FeO2+NaNO2+5H2O→3Na2Fe2O4+ NH3↑+7NaOH;
③ Na2FeO2+ Na2Fe2O4+2H2O→Fe3O4+4NaOH;
下列说法正确的是 ( )
A.该生产过程不会产生污染 B.反应①②中的氧化剂均为NaNO2
C.反应①②③均是氧化还原反应 D.四氧化三铁具有抗腐蚀作用
[答案]BD
12. Na2FeO4是一种高效多功能水处理剂,应用前景广阔。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中不正确的是 ( )
A.Na2O2在反应中只作氧化剂
B.O2是氧化产物
C.Na2FeO4既是氧化产物又是还原产物
D.有2mol FeSO4参加发生反应时,反应中共有8mol电子转移
[答案]AD
11. 在Cu2S+2Cu2O===6Cu+SO2↑反应中,说法正确的是 ( )
A.Cu2S在反应中既是氧化剂,又是还原剂
B.Cu是氧化产物
C.氧化剂只有Cu2O
D.生成1mol Cu,反应中转移2mol电子
[答案]A
10. 根据下表信息,下列叙述中正确的是 ( )
|
序号 |
氧化剂 |
还原剂 |
其他反应物 |
氧化产物 |
还原产物 |
|
① |
Cl2 |
FeBr2 |
|
|
Cl- |
|
② |
KMnO4 |
H2O2 |
H2SO4 |
O2 |
Mn2+ |
|
③ |
KClO3 |
浓盐酸 |
|
Cl2 |
|
|
④ |
KMnO4 |
浓盐酸 |
|
Cl2 |
Mn2+ |
A.表中①组反应的氧化产物只能有FeCl3
B.氧化性强弱比较:KMnO4>Fe3+>Cl2>Fe2+
C.④的离子方程式配平后,H+的化学计量数为16
D.表中③还原产物是KCl
[答案]C
9. 下列反应是非氧化还原反应的是 ( )
A.3CuS+8HNO3=3Cu(NO3)2+2NO↑+3S↓+4H2O
B.3Cl2+6KOH=5KCl+KclO3+3H2O
C.3H2O2+2KcrO2+2KOH=2K2CrO4+4H2O
D.3CCl4+K2Cr2O7=2CrO2Cl2+3COCl2+2KCl
[答案]A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com