
8. 被称为万能还原剂的NaBH4溶于水并和水发生反应:NaBH4+2H2O=NaBO2+4H2↑,下列说法中正确的是(NaBH4中H为-1价) ( )
A.被氧化的元素与被还原的元素质量比为1︰1 B.NaBH4是氧化剂,H2O是还原剂
C.硼元素被氧化,氢元素被还原 D. NaBH4既是氧化剂又是还原剂
7. MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:
⑴ 软锰矿、闪锌矿与硫酸共热: MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O。
⑵ 除去反应混合物中的不溶物
 ⑶ 电解混合液MnSO4+ZnSO4+2H2O
MnO2+Zn+2H2SO4
⑶ 电解混合液MnSO4+ZnSO4+2H2O
MnO2+Zn+2H2SO4
下列说法不正确的是 ( )
A.步骤⑴中MnO2和H2SO4都是氧化剂
B.步骤⑴中每析出12.8g S沉淀共转移0.8mol电子
C.电解时MnO2在阳极处产生
D.硫酸在生产中可循环使用
6. Cl2在70℃的NaOH水溶液中,能同时发生两个自身氧化还原反应,反应完全后测得溶液中NaClO和NaClO3的物质的量比为4∶1,则溶液中NaCl和NaClO的物质的量之比为:
A.9∶4 B.5∶1 C.11∶2 D.1∶1
5. 吸进人体内的氧有2%转化为氧化性极强的活性氧,这 些活性氧能加速人体衰老,被称为“生命杀手”。中国科学家尝试用Na2SeO3清除人体内活性氧,Na2SeO3的作用是 ( )
A.还原剂 B.氧化剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
4. 下列环境下物质处于还原性氛围的是 ( )
①地球表面 ②沼气池 ③漂白粉溶液
A.②③ B.①② C.只有① D.只有②
3. F2和Xe在一定条件下可生成氧化性极强且极易水解的XeF2、XeF4和XeF6三种化合物。如XeF4与水可发生如下反应:6XeF4+12H2O==2XeO3+4Xe↑+24HF+3O2↑。下列判断中正确的是 ( )
A.XeF2分子中各原子均达到八电子结构
B.XeF6分子中Xe的化合价为+6价
C.上述反应中氧化剂和还原剂的物质的量之比为1∶2
D.XeF4按已知方式水解,每生成4molXe,转移12mol电子
2. 已知A2O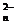 可将B2-氧化为B单质,A2O
可将B2-氧化为B单质,A2O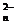 则被还原为A3+,又知100mL的0.3mol/L的A2O
则被还原为A3+,又知100mL的0.3mol/L的A2O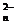 与150mL的0.6mol/L B2-恰好完全反应,则A2O
与150mL的0.6mol/L B2-恰好完全反应,则A2O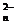 中的n值为
( )
中的n值为
( )
A.4 B.5 C.6 D.7
1. 下列反应属于氧化还原反应,但水既不作氧化剂也不作还原剂的是 ( )
A.CO2+H2O H2CO3
B.2Na2O2+2H2O=4NaOH+O2↑
H2CO3
B.2Na2O2+2H2O=4NaOH+O2↑
C.3Fe+4H2O(g)  Fe2O4+4H2
D.2Na+2H2O=2NaOH+H2↑
Fe2O4+4H2
D.2Na+2H2O=2NaOH+H2↑
4. 某厂废水中含5.00×10-3mol·L-1的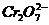 ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料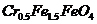 (
(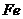 的化合价依次为+3、+2),设计了如下实验流程:
的化合价依次为+3、+2),设计了如下实验流程:
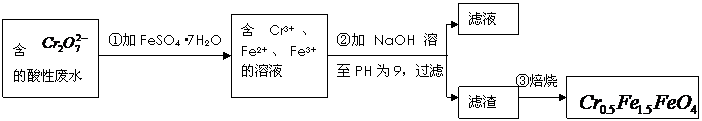
(1)第①步反应的离子方程式是
(2)第②步中用PH试纸测定溶液PH的操作是:
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有
(4)欲使1L该废水中的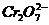 完全转化为
完全转化为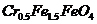 。理论上需要加入
。理论上需要加入
GFeSO4·7H2O。
[答案]
(1)Cr2O72- + 6Fe2+ + 14H+  2Cr3+ + 6Fe3+ + 7H2O
2Cr3+ + 6Fe3+ + 7H2O
(2)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照
(3)Fe(OH)3、Fe(OH)2
(4)13.9
[解析](1)第①步是Cr2O72-与Fe2+发生氧化还原反应,方程式为:
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(2)测定溶液的pH的方法是:用玻璃棒蘸取待测溶液滴在pH试纸的中心位置,然后对照标准比色卡,读出对应颜色的数据;
(3)从最终所得磁性材料的化学式可知,滤渣中主要有Cr(OH)3、Fe(OH)2、Fe(OH)3;
(4)1L废水中的n(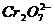 )=5.00×10-3mol,根据关系式:
)=5.00×10-3mol,根据关系式: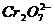 -4Cr0.5Fe1.5FeO4-10FeSO4·7H2O,所以理论上n(FeSO4·7H2O)=0.05mol,m(FeSO4·7H2O)= 0.05mol
-4Cr0.5Fe1.5FeO4-10FeSO4·7H2O,所以理论上n(FeSO4·7H2O)=0.05mol,m(FeSO4·7H2O)= 0.05mol
[考点分析]氧化还原反应综合应用
[专题考案]
3.(1)配平氧化还原反应方程式:
__ C2O42-+__MnO4-+__H+= __CO2+__Mn2++__H2O
(2)称取6.0 g含H2C2O4·2H2O、KOH、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为___mol。
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由__变为__。该溶液中还原剂的物质的量为___mol。
③原试样中H2C2O4·2H2O的质量分数为___。KHC2O4的质量分数为___。
[答案](1)5 2 16 10 2 8
(2)①0.005;②无色;紫红色;0.004。 ③21%;64%。
[解析](1)C:+3→+4,改变量(4-3)×2=2,Mn:+7→+2,改变量(7-2)×1=5,根据化合价升降总数相等,所以在C2O42-前配5,MnO4-前配2,根据C和Mn原子守恒,分别在CO2和Mn2+前配10和2,再由电荷守恒在H+前配16,最后根据离子方程式两边的H个数相等在水前面配8,经检验离子方程式两边的氧原子相等。
(2)①由H++OH- ===H2O知,n(H+)=n(OH-)=0.25mol·L-1×0.02L=0.005mol。
②原溶液无色,而KMnO4为紫红色,所以当溶液中的H2C2O4和KHC2O4反应完全时,溶液呈紫红色。
由电子守恒得:n(还)×2=0.1mol·L-1×0.016L×5,n(还)=0.004mol。
③由于实验时所取溶液均为配置时的,所以①、②中计算的数据均为配置溶液中溶质的,由①得:2n(H2C2O4·2H2O)+n(KHC2O4)=0.05mol,由②得:n(H2C2O4·2H2O)+n(KHC2O4)=0.04mol,解上述两个方程式得:n(H2C2O4·2H2O)=0.01mol,n(KHC2O4)=0.03mol,H2C2O4·2H2O的质量分数为:×100%=21%,KHC2O4的质量分数为:×100%=64%。
[考点分析]将酸碱中和滴定的知识迁移到氧化还原反应中。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com